Związki Węgla Z Wodorem Sprawdzian Klasa 8
Witajcie w świecie związków węgla z wodorem, czyli węglowodorów! To fascynujący temat, który jest podstawą chemii organicznej i który na pewno pojawi się na Waszym sprawdzianie w 8 klasie. Spróbujemy go razem zrozumieć krok po kroku.
Co to są węglowodory?
Najprościej mówiąc, węglowodory to związki chemiczne składające się wyłącznie z atomów węgla (C) i wodoru (H). Słowo "węglowodór" samo to sugeruje – "węgiel" i "wodór". Atomy węgla mogą łączyć się ze sobą, tworząc łańcuchy, pierścienie, a nawet bardziej skomplikowane struktury. Do tych węglowych "szkieletów" dołączają się atomy wodoru, wypełniając pozostałe wolne miejsca.
Węgiel jest wyjątkowy, ponieważ może tworzyć aż cztery wiązania chemiczne. Dzięki temu ma ogromne możliwości łączenia się z innymi atomami, w tym z sobą samym, co prowadzi do powstawania ogromnej różnorodności związków.
Przykłady węglowodorów
Na pewno znacie już niektóre węglowodory, nawet o tym nie wiedząc! Oto kilka przykładów:
- Metan (CH4): To najprostszy węglowodór. Jest głównym składnikiem gazu ziemnego i powstaje podczas rozkładu materii organicznej (np. na bagnach).
- Etan (C2H6): Kolejny składnik gazu ziemnego, używany także jako paliwo.
- Propan (C3H8): Powszechnie stosowany w butlach gazowych (np. do kuchenek turystycznych) oraz jako paliwo.
- Butan (C4H10): Podobnie jak propan, używany jako paliwo, np. w zapalniczkach.
- Benzyna: Mieszanina wielu różnych węglowodorów, głównie od C5 do C12, używana jako paliwo do samochodów.
Podział węglowodorów
Węglowodory możemy podzielić na różne sposoby, ale najczęściej rozróżniamy je ze względu na strukturę ich łańcucha węglowego oraz rodzaj wiązań między atomami węgla.
Podział ze względu na strukturę łańcucha:
- Węglowodory alifatyczne: Charakteryzują się otwartym łańcuchem węglowym, który może być prosty lub rozgałęziony. Dzielimy je dalej na:
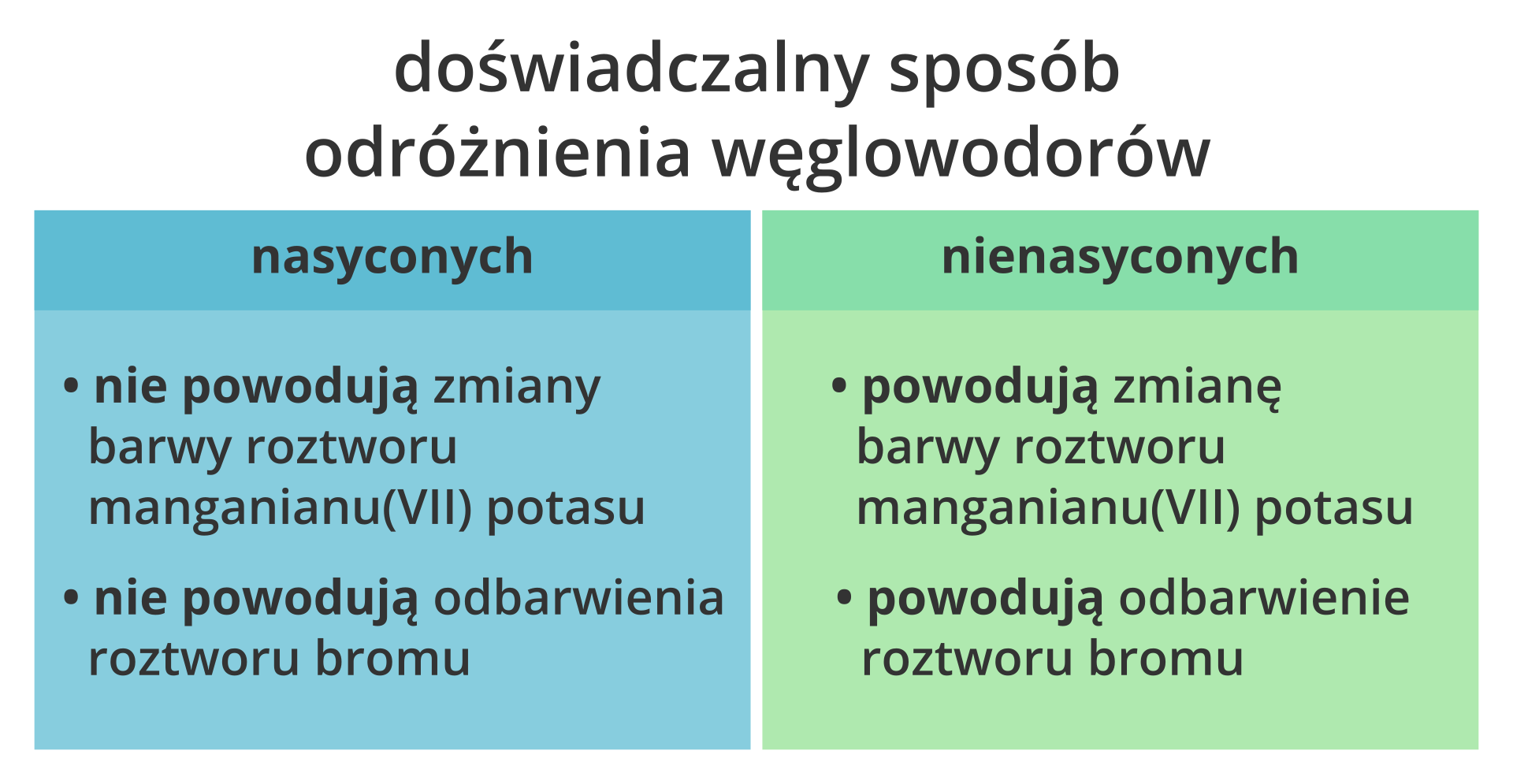
- Węglowodory nasycone (alkany): Zawierają tylko pojedyncze wiązania między atomami węgla.
- Węglowodory nienasycone (alkeny i alkini): Zawierają co najmniej jedno wiązanie podwójne (alkeny) lub potrójne (alkiny) między atomami węgla.
- Węglowodory cykliczne (pierścieniowe): Atomy węgla tworzą zamknięty pierścień. Podobnie jak węglowodory alifatyczne, mogą być nasycone (cykloalkany) lub nienasycone (np. związki aromatyczne, takie jak benzen).
Podział ze względu na rodzaj wiązań:
- Węglowodory nasycone (alkany): Jak wspomniano, zawierają tylko pojedyncze wiązania między atomami węgla. Mają ogólny wzór CnH2n+2. Są stosunkowo mało reaktywne. Przykładem jest metan (CH4).
- Węglowodory nienasycone:
- Alkeny: Zawierają co najmniej jedno wiązanie podwójne między atomami węgla. Mają ogólny wzór CnH2n. Są bardziej reaktywne niż alkany. Przykładem jest eten (C2H4).
- Alkiny: Zawierają co najmniej jedno wiązanie potrójne między atomami węgla. Mają ogólny wzór CnH2n-2. Są bardzo reaktywne. Przykładem jest etyn (acetylen, C2H2).
- Węglowodory aromatyczne: Charakteryzują się obecnością pierścienia aromatycznego (np. benzenu). Posiadają specjalne właściwości chemiczne i fizyczne.
Właściwości węglowodorów
Właściwości fizyczne węglowodorów zależą od ich masy cząsteczkowej i struktury. Ogólnie rzecz biorąc:
- Węglowodory o małej masie cząsteczkowej (np. metan, etan, propan, butan) są gazami w temperaturze pokojowej.
- Węglowodory o średniej masie cząsteczkowej (np. pentan, heksan, heptan) są cieczami.
- Węglowodory o dużej masie cząsteczkowej (np. woski, parafina) są ciałami stałymi.
Wszystkie węglowodory są nierozpuszczalne w wodzie, ale dobrze rozpuszczają się w rozpuszczalnikach organicznych. Są również palne – spalanie węglowodorów jest reakcją egzotermiczną, czyli wydzielającą ciepło. To właśnie dzięki spalaniu węglowodorów możemy ogrzewać nasze domy i napędzać samochody.
Reakcje węglowodorów
Węglowodory biorą udział w różnych reakcjach chemicznych. Najważniejsze z nich to:
- Spalanie: Reakcja z tlenem, w wyniku której powstaje dwutlenek węgla i woda (przy spalaniu całkowitym) lub tlenek węgla i woda (przy spalaniu niecałkowitym).
- Substytucja (podstawianie): Charakterystyczna dla alkanów. Atom wodoru zostaje zastąpiony innym atomem lub grupą atomów.
- Addycja (przyłączanie): Charakterystyczna dla alkenów i alkinów. Atomy lub grupy atomów przyłączają się do wiązania podwójnego lub potrójnego, "likwidując" to wiązanie.
- Polimeryzacja: Małe cząsteczki (monomery), np. etenu, łączą się w długi łańcuch, tworząc polimer (np. polietylen).
Zastosowania węglowodorów
Węglowodory mają bardzo szerokie zastosowanie. Oto kilka przykładów:
- Paliwa: Benzyna, olej napędowy, gaz ziemny, propan, butan – wszystkie te paliwa to mieszaniny węglowodorów.
- Surowce do produkcji tworzyw sztucznych: Wiele tworzyw sztucznych (np. polietylen, polipropylen) powstaje w wyniku polimeryzacji węglowodorów.
- Rozpuszczalniki: Niektóre węglowodory są używane jako rozpuszczalniki farb, lakierów i innych substancji.
- Smarowidła: Oleje mineralne i smary to mieszaniny węglowodorów o wysokiej masie cząsteczkowej.
- Asfalt: Używany do budowy dróg.
Mam nadzieję, że ten artykuł pomógł Wam zrozumieć podstawy chemii węglowodorów. Pamiętajcie, żeby dobrze powtórzyć definicje, rodzaje węglowodorów i ich właściwości – to na pewno przyda się na sprawdzianie! Powodzenia!
Pamiętaj! Zrozumienie zasad chemii organicznej, a w szczególności węglowodorów, to klucz do dalszej nauki chemii!