Związki Węgla Z Wodorem Klasa 8

Cześć! Zapewne trafiłeś tutaj, bo chemia, a dokładniej związki węgla z wodorem, czyli węglowodory, spędzają Ci sen z powiek. Nie martw się, to temat, który początkowo może wydawać się trudny, ale postaram się go wytłumaczyć w sposób prosty i przystępny, tak abyś po przeczytaniu tego artykułu czuł się pewniej na lekcjach chemii.
Węglowodory – Co to właściwie jest?
Wyobraź sobie, że masz zestaw klocków: jeden rodzaj to węgiel (C), a drugi to wodór (H). Budując różne konstrukcje z tych klocków, otrzymujesz różne węglowodory. Węglowodory to związki chemiczne zbudowane wyłącznie z atomów węgla i wodoru. Są one podstawą chemii organicznej i znajdują się dosłownie wszędzie wokół nas – od paliw, przez tworzywa sztuczne, po składniki naturalne takie jak tłuszcze i oleje.
Dlaczego węgiel i wodór tak dobrze się łączą? Węgiel ma 4 wolne elektrony, którymi chętnie się dzieli, tworząc 4 wiązania. Wodór ma tylko 1 elektron, więc tworzy jedno wiązanie. Ta "chęć" węgla do wiązania się z czterema innymi atomami sprawia, że może tworzyć bardzo długie i skomplikowane łańcuchy i pierścienie.
Dlaczego węglowodory są tak ważne?
Węglowodory to nie tylko ciekawostka chemiczna – mają ogromny wpływ na nasze życie. Pomyśl o tym:
- Paliwa: Benzyna, gaz ziemny, olej napędowy – wszystko to mieszaniny węglowodorów. Napędzają nasze samochody, ogrzewają domy i generują energię elektryczną.
- Tworzywa sztuczne: Plastiki, z których wykonane są butelki, zabawki, opakowania, a nawet ubrania, są również wytwarzane z węglowodorów.
- Naturalne surowce: Tłuszcze, oleje, woski – to wszystko węglowodory lub ich pochodne, niezbędne do funkcjonowania organizmów żywych.
- Leki: Wiele leków zawiera w swojej strukturze węglowodory, które wpływają na ich działanie.
Widzisz więc, że węglowodory są dosłownie wszędzie! Bez nich nasze życie byłoby zupełnie inne.
Podział węglowodorów
Węglowodory dzielimy na różne grupy, w zależności od rodzaju wiązań między atomami węgla i od kształtu cząsteczki. Najczęściej spotykany podział to:
- Węglowodory alifatyczne: To węglowodory o łańcuchach prostych lub rozgałęzionych, ale nie tworzących pierścieni. Dzielimy je dalej na:
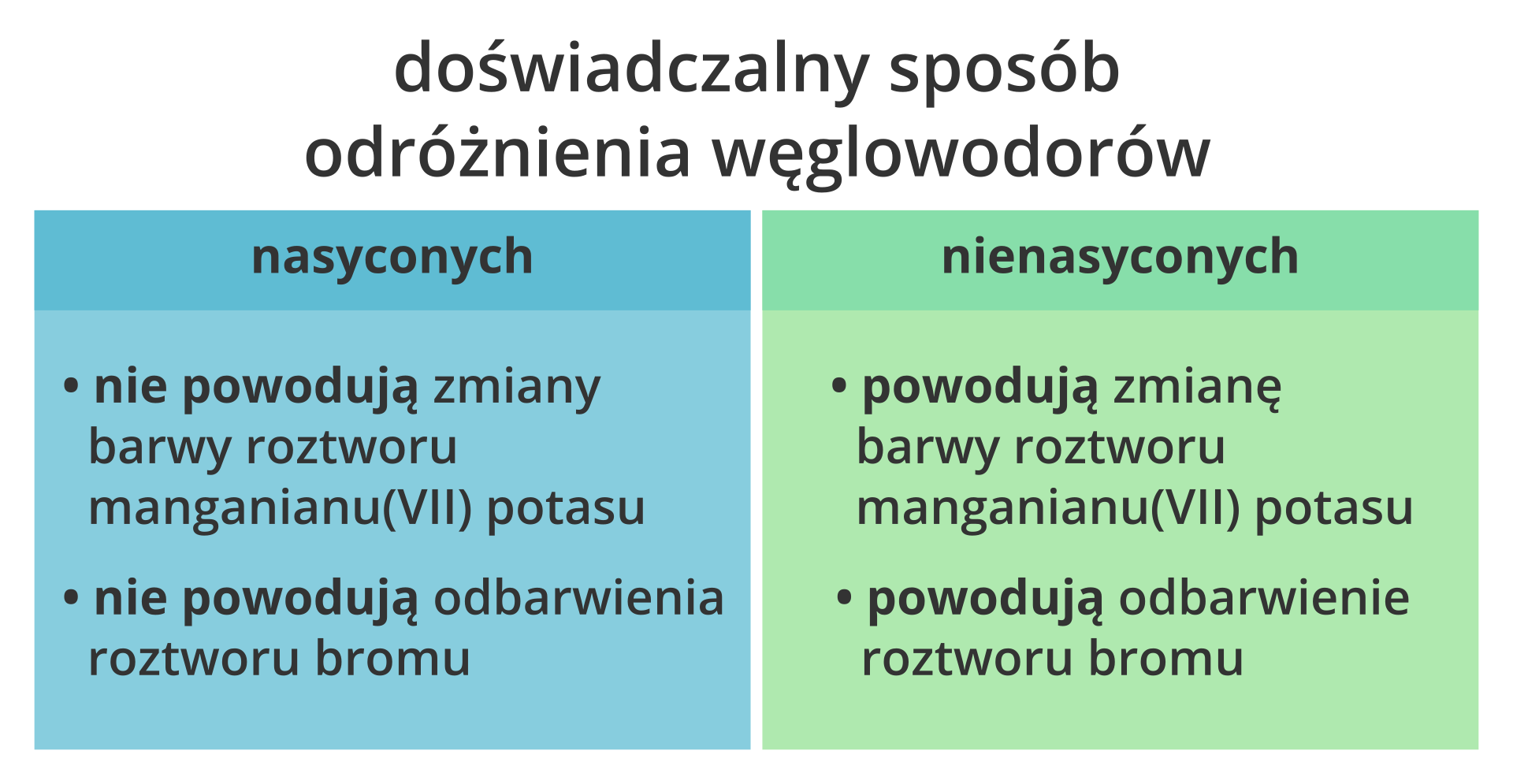
- Alkany (parafiny): Mają tylko pojedyncze wiązania między atomami węgla (np. metan, etan, propan, butan). Są nasycone, co oznacza, że każdy atom węgla ma maksymalną liczbę atomów wodoru, z którymi może się połączyć.
- Alkeny (olefiny): Zawierają przynajmniej jedno wiązanie podwójne między atomami węgla (np. eten, propen, buten). Są nienasycone.
- Alkiny (acetyleny): Zawierają przynajmniej jedno wiązanie potrójne między atomami węgla (np. etyn, propyn, butyn). Są również nienasycone.
- Węglowodory cykliczne: To węglowodory, w których atom węgla tworzy pierścień. Podobnie jak alifatyczne, mogą być nasycone (cykloalkany) lub nienasycone (cykloalkeny, cykloalkiny).
- Węglowodory aromatyczne: To szczególny rodzaj węglowodorów cyklicznych, charakteryzujący się obecnością pierścienia benzenowego (np. benzen, toluen). Wykazują specyficzne właściwości chemiczne.
Zapamiętanie tych nazw i podziałów może wydawać się trudne, ale z czasem i praktyką stanie się to łatwiejsze. Skup się na zrozumieniu różnicy między alkanami, alkenami i alkinami – to podstawa!
Różnica między alkanami, alkenami i alkinami – Jak to zapamiętać?
Najprościej:
- Alkany (np. metan, etan) – "Alkany są Absolutnie pojedyncze" – mają tylko pojedyncze wiązania.
- Alkeny (np. eten, propen) – "Elenki lubią wiązania podwójne" – mają przynajmniej jedno wiązanie podwójne.
- Alkiny (np. etyn, propyn) – "Innowacyjne związki z wiązaniem potrójnym" - mają przynajmniej jedno wiązanie potrójne.
Reakcje charakterystyczne dla węglowodorów
Węglowodory, ze względu na swoją budowę, podlegają różnym reakcjom chemicznym. Najważniejsze z nich to:
- Spalanie: Reakcja z tlenem, w wyniku której powstaje dwutlenek węgla i woda, a wydziela się energia (ciepło i światło). Spalanie jest procesem wykorzystywanym w silnikach spalinowych i elektrowniach.
Przykładowa reakcja spalania metanu (gazu ziemnego): CH4 + 2O2 → CO2 + 2H2O
- Addycja (przyłączenie): Reakcja charakterystyczna dla węglowodorów nienasyconych (alkenów i alkinów), w której atom lub grupa atomów przyłącza się do atomów węgla połączonych wiązaniem wielokrotnym, powodując jego rozerwanie. Przykładem jest przyłączenie wodoru do etenu (uwodornienie).
- Substytucja (podstawienie): Reakcja charakterystyczna dla węglowodorów nasyconych (alkanów) i aromatycznych, w której atom wodoru w cząsteczce węglowodoru zostaje zastąpiony przez inny atom lub grupę atomów. Przykładem jest chlorowanie metanu.
- Polimeryzacja: Reakcja, w której wiele małych cząsteczek (monomerów) łączy się ze sobą, tworząc dużą cząsteczkę (polimer). Węglowodory nienasycone, takie jak eten, są często wykorzystywane do produkcji polimerów (np. polietylenu – PE).
Zrozumienie tych reakcji jest kluczowe do zrozumienia, jak węglowodory są wykorzystywane w przemyśle chemicznym.
Nazewnictwo węglowodorów
Każdy węglowodór ma swoją unikalną nazwę, która jest tworzona według określonych zasad. Naukowe nazewnictwo węglowodorów jest systematyczne i oparte na liczbie atomów węgla w łańcuchu głównym oraz na obecności i położeniu wiązań wielokrotnych i podstawników. Spróbujmy to uprościć:
- Podstawa nazwy: Liczba atomów węgla w łańcuchu głównym (np. met- dla 1 atomu węgla, et- dla 2, prop- dla 3, but- dla 4, pent- dla 5, heks- dla 6, hept- dla 7, okt- dla 8, non- dla 9, dek- dla 10).
- Końcówka nazwy: Określa rodzaj wiązania:
- -an dla alkanów (tylko wiązania pojedyncze)
- -en dla alkenów (przynajmniej jedno wiązanie podwójne)
- -in dla alkinów (przynajmniej jedno wiązanie potrójne)
- Położenie wiązania wielokrotnego: W przypadku alkenów i alkinów podajemy numer atomu węgla, od którego zaczyna się wiązanie wielokrotne (np. but-1-en).
- Podstawniki: Jeśli do łańcucha węglowego przyłączone są inne atomy lub grupy atomów (podstawniki), to podajemy ich nazwę i położenie (np. 2-metylobutan).
Przykład: CH3-CH2-CH3 to propan (3 atomy węgla, tylko wiązania pojedyncze).
Wpływ węglowodorów na środowisko
Spalanie węglowodorów, szczególnie w dużych ilościach, ma negatywny wpływ na środowisko. Emitowane gazy cieplarniane, takie jak dwutlenek węgla (CO2), przyczyniają się do globalnego ocieplenia i zmian klimatycznych. Ponadto, spalanie niecałkowite węglowodorów prowadzi do powstawania szkodliwych substancji, takich jak tlenek węgla (CO) i pyły zawieszone, które zanieczyszczają powietrze.
Wycieki ropy naftowej i innych węglowodorów do środowiska (np. do wód) powodują skażenie gleby i wody, zagrażając życiu roślin i zwierząt. Ograniczenie zużycia paliw kopalnych, rozwój odnawialnych źródeł energii i poprawa efektywności energetycznej to kluczowe działania, które mogą zmniejszyć negatywny wpływ węglowodorów na środowisko.
Niektórzy twierdzą, że przejście na alternatywne źródła energii jest nierealne ze względu na koszty i technologię. Jednakże, inwestycje w energię słoneczną, wiatrową i geotermalną stale rosną, a ich koszty spadają, co czyni je coraz bardziej konkurencyjnymi w stosunku do paliw kopalnych. Ponadto, rozwijane są technologie wychwytywania i składowania dwutlenku węgla (CCS), które mogą zmniejszyć emisję CO2 z elektrowni i zakładów przemysłowych.
Podsumowanie i przydatne wskazówki
Węglowodory to fascynująca i bardzo ważna grupa związków chemicznych. Zrozumienie ich budowy, podziału, właściwości i reakcji jest kluczowe do zrozumienia chemii organicznej i jej wpływu na nasze życie.
Kilka przydatnych wskazówek:- Ucz się stopniowo: Nie próbuj zapamiętać wszystkiego na raz. Skup się na zrozumieniu podstawowych pojęć i podziałów.
- Rysuj wzory: Rysowanie wzorów strukturalnych węglowodorów pomaga zrozumieć ich budowę i właściwości.
- Rozwiązuj zadania: Ćwiczenia praktyczne pomagają utrwalić wiedzę i zrozumieć zasady nazewnictwa.
- Szukaj analogii: Porównywanie węglowodorów do klocków lub innych znanych obiektów może ułatwić ich zrozumienie.
- Nie bój się pytać: Jeśli masz jakieś pytania, nie wahaj się zapytać nauczyciela, kolegów lub poszukać odpowiedzi w Internecie.
Mam nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć związki węgla z wodorem. Czy czujesz się teraz pewniej, omawiając temat węglowodorów?