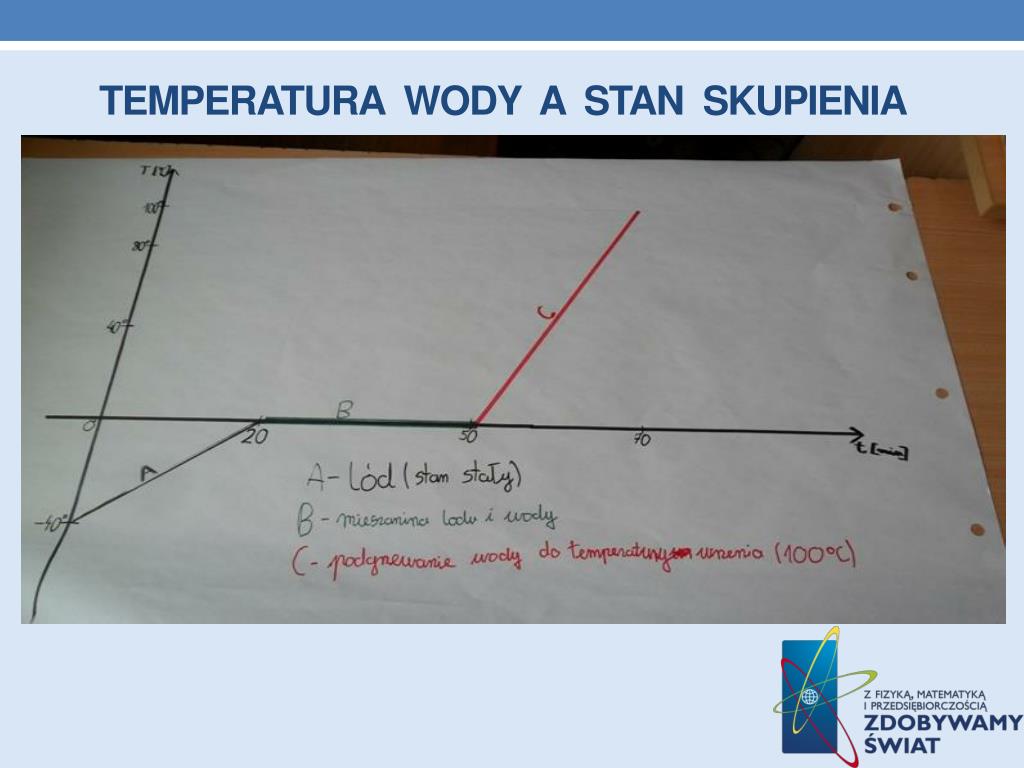
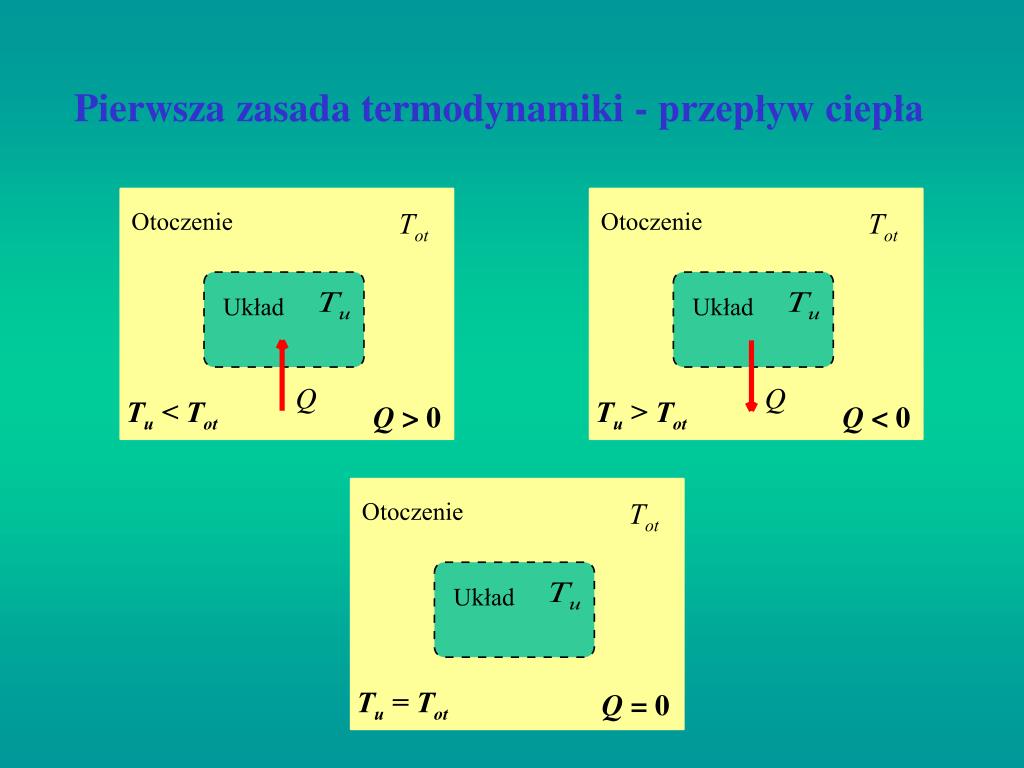
Zmiana Energii Wewnętrznej W Wyniku Pracy I Przepływu Ciepła

Energia wewnętrzna ciała, stanowiąca sumę energii kinetycznej i potencjalnej wszystkich cząsteczek w nim zawartych, jest wielkością charakteryzującą stan termodynamiczny układu. Jej zmiana, oznaczana jako ΔU, odzwierciedla różnicę między końcową i początkową energią wewnętrzną. Możemy dokonać tej zmiany na dwa fundamentalne sposoby: poprzez wykonanie pracy (W) nad układem lub przez przepływ ciepła (Q) do układu lub z układu. Związek między tymi wielkościami opisuje Pierwsza Zasada Termodynamiki, która stanowi fundament całej termodynamiki. Mówi ona, że zmiana energii wewnętrznej układu jest równa sumie ciepła dostarczonego do układu i pracy wykonanej nad układem: ΔU = Q + W.
Zrozumienie tego związku jest kluczowe do analizy procesów termodynamicznych, od pracy silników spalinowych po zachodzące w naszym ciele przemiany metaboliczne. Zanim jednak zagłębimy się w konkretne przykłady, warto przyjrzeć się bliżej poszczególnym składowym tego równania.
Ciepło (Q) to energia przekazywana między układami lub między częściami tego samego układu, w wyniku różnicy temperatur. Przepływ ciepła zawsze odbywa się od ciała o wyższej temperaturze do ciała o niższej temperaturze. Ciepło może być przekazywane na kilka sposobów: poprzez przewodnictwo, konwekcję i promieniowanie. Przewodnictwo polega na przekazywaniu energii kinetycznej między sąsiadującymi cząsteczkami. Konwekcja polega na przenoszeniu ciepła przez ruch mas płynu (cieczy lub gazu). Promieniowanie natomiast to emisja i absorpcja fal elektromagnetycznych, które transportują energię. Warto zaznaczyć, że ciepło nie jest funkcją stanu, co oznacza, że jego wartość zależy od drogi, jaką przebywa układ podczas zmiany stanu. Oznacza to, że ta sama zmiana stanu może być osiągnięta poprzez różne procesy, w których przekazywane ciepło będzie różne.
Praca (W), w kontekście termodynamiki, to energia przekazywana między układami w wyniku działania siły na przesunięcie. Najczęściej rozpatruje się pracę związaną ze zmianą objętości gazu, którą można obliczyć jako W = -pΔV, gdzie p to ciśnienie, a ΔV to zmiana objętości. Praca wykonywana nad układem jest dodatnia (W > 0), co zwiększa energię wewnętrzną układu, natomiast praca wykonywana przez układ jest ujemna (W < 0), co zmniejsza energię wewnętrzną. Podobnie jak ciepło, praca również nie jest funkcją stanu i zależy od drogi procesu. Rozważmy przykład: gaz zamknięty w cylindrze z ruchomym tłokiem. Jeśli gaz rozpręża się, pchając tłok, wykonuje pracę nad otoczeniem, a jego energia wewnętrzna maleje (jeśli nie dostarczymy ciepła). Z drugiej strony, jeśli my ściskamy gaz, wykonujemy pracę nad gazem, zwiększając jego energię wewnętrzną (wzrost temperatury).
Procesy Termodynamiczne i Zmiana Energii Wewnętrznej
Analiza różnych procesów termodynamicznych pozwala lepiej zrozumieć wpływ pracy i ciepła na zmianę energii wewnętrznej. Rozważmy kilka przykładów.
-
Proces izobaryczny (p = const): W procesie izobarycznym ciśnienie układu jest stałe. Zmiana energii wewnętrznej jest wówczas sumą ciepła dostarczonego (lub oddanego) i pracy wykonanej przez (lub nad) układem przy stałym ciśnieniu. Zarówno ciepło, jak i praca, w tym procesie, są różne od zera, a ich wartości zależą od zmiany objętości i temperatury. Przykładem może być ogrzewanie wody w otwartym naczyniu.
-
Proces izochoryczny (V = const): W procesie izochorycznym objętość układu jest stała. Ponieważ objętość się nie zmienia, praca wykonywana przez układ jest równa zeru (W = 0). W związku z tym, cała zmiana energii wewnętrznej jest równa ciepłu dostarczonemu (lub oddanemu): ΔU = Q. Przykładem jest ogrzewanie gazu w zamkniętym, sztywnym pojemniku.
-
Proces izotermiczny (T = const): W procesie izotermicznym temperatura układu jest stała. W przypadku gazu doskonałego, energia wewnętrzna zależy tylko od temperatury, więc zmiana energii wewnętrznej jest równa zeru (ΔU = 0). Zatem, ciepło dostarczone do układu jest w całości zamieniane na pracę wykonywaną przez układ (Q = -W), lub odwrotnie. Przykładem może być bardzo powolne rozprężanie gazu w cylindrze, który jest w kontakcie z dużym zbiornikiem ciepła (termostatem), który utrzymuje stałą temperaturę.
-
Proces adiabatyczny (Q = 0): W procesie adiabatycznym nie ma wymiany ciepła z otoczeniem (Q = 0). Zmiana energii wewnętrznej jest równa pracy wykonanej nad układem (ΔU = W). Oznacza to, że wykonanie pracy nad układem (np. sprężenie gazu) powoduje wzrost jego energii wewnętrznej i temperatury, a wykonanie pracy przez układ (np. rozprężenie gazu) powoduje spadek jego energii wewnętrznej i temperatury. Przykładem może być szybkie sprężenie powietrza w pompce rowerowej, co powoduje jej nagrzewanie.
Warto zauważyć, że rzeczywiste procesy termodynamiczne rzadko są idealnie izobaryczne, izochoryczne, izotermiczne lub adiabatyczne. Zazwyczaj są to procesy bardziej złożone, w których zarówno ciśnienie, objętość, jak i temperatura zmieniają się w sposób skomplikowany. Niemniej jednak, analiza idealnych procesów stanowi cenną podstawę do zrozumienia zachowania układów termodynamicznych.
Rozważmy teraz przykład praktyczny: silnik spalinowy. W silniku spalinowym cykl pracy składa się z kilku etapów, w których zachodzą różne procesy termodynamiczne. Podczas suwu ssania, do cylindra wciągana jest mieszanka paliwowo-powietrzna. Następnie, podczas suwu sprężania, mieszanka jest sprężana, co powoduje wzrost jej temperatury (proces zbliżony do adiabatycznego). Kolejny etap to zapłon, w którym następuje gwałtowne spalanie paliwa, co powoduje gwałtowny wzrost ciśnienia i temperatury (dostarczenie ciepła). W końcu, podczas suwu wydechu, spaliny są usuwane z cylindra, a cykl się powtarza. W każdym z tych etapów zachodzi zmiana energii wewnętrznej gazu, wynikająca z pracy wykonanej nad gazem lub przez gaz oraz z wymiany ciepła z otoczeniem. Efektywność silnika zależy od tego, jak skutecznie ciepło uzyskane ze spalania paliwa jest zamieniane na pracę mechaniczną.
Podsumowując, zmiana energii wewnętrznej układu jest fundamentalnym pojęciem w termodynamice, a zrozumienie związku między nią, pracą i ciepłem jest kluczowe do analizy i projektowania różnorodnych systemów, od silników spalinowych po układy chłodnicze. Analiza procesów termodynamicznych pozwala na optymalizację tych systemów i poprawę ich efektywności. Znajomość zasad termodynamiki ma również znaczenie w wielu innych dziedzinach, takich jak chemia, inżynieria materiałowa czy meteorologia.