Zestaw 5 Woda I Roztwory Wodne

Woda i roztwory wodne to fundamentalne pojęcia w chemii, biologii i wielu innych dziedzinach nauki. Stanowią one podstawę życia na Ziemi i odgrywają kluczową rolę w większości procesów zachodzących w naszym otoczeniu. Zrozumienie właściwości wody i jej zdolności do rozpuszczania różnych substancji jest niezbędne do zrozumienia wielu zjawisk naturalnych i technologicznych.
Kluczowe Właściwości Wody
Woda, chemicznie oznaczana jako H2O, to niezwykła substancja posiadająca unikalne właściwości, które wynikają z jej struktury molekularnej. Te właściwości czynią ją wyjątkowym rozpuszczalnikiem i niezbędnym elementem życia.
Polarność Molekuły Wody
Molekuła wody jest polarna. Atom tlenu jest bardziej elektroujemny niż atomy wodoru, co oznacza, że przyciąga elektrony silniej. Powoduje to powstanie cząstkowego ładunku ujemnego na atomie tlenu oraz cząstkowych ładunków dodatnich na atomach wodoru. Ta nierównomierność rozkładu ładunku elektrycznego prowadzi do powstawania dipola elektrycznego.
Polarność wody umożliwia tworzenie wiązań wodorowych między sąsiednimi molekułami wody. Atom wodoru z ładunkiem dodatnim jednej cząsteczki przyciąga atom tlenu z ładunkiem ujemnym innej cząsteczki. Te wiązania, choć stosunkowo słabe w porównaniu z wiązaniami kowalencyjnymi, mają ogromny wpływ na właściwości fizyczne wody.
Wysokie Ciepło Właściwe i Ciepło Parowania
Woda ma wysokie ciepło właściwe, co oznacza, że potrzeba dużo energii, aby podgrzać jej temperaturę o 1 stopień Celsjusza. Dzieje się tak, ponieważ energia jest zużywana na zerwanie lub osłabienie wiązań wodorowych między molekułami wody, zanim zacznie się zwiększać ich energia kinetyczna, a więc i temperatura.
Podobnie, woda ma wysokie ciepło parowania. Znaczna ilość energii jest wymagana do przejścia wody ze stanu ciekłego w stan gazowy. Energia ta jest potrzebna do całkowitego zerwania wiązań wodorowych. Te właściwości odgrywają kluczową rolę w regulacji temperatury na Ziemi, zapobiegając ekstremalnym wahaniom temperatury w środowisku.
Napięcie Powierzchniowe
Woda wykazuje napięcie powierzchniowe, które wynika z kohezji (przyciągania między cząsteczkami tej samej substancji) molekuł wody. Molekuły na powierzchni wody są silniej przyciągane do sąsiednich molekuł niż do powietrza powyżej, co powoduje powstanie "błony" na powierzchni. Dzięki temu niektóre owady mogą chodzić po powierzchni wody.
Roztwory Wodne: Mieszaniny Homogeniczne
Roztwór wodny to mieszanina homogeniczna, w której woda (rozpuszczalnik) rozpuszcza jedną lub więcej substancji (substancji rozpuszczonych). Homogeniczność oznacza, że skład roztworu jest jednolity w całej objętości. Właściwości roztworu wodnego zależą od rodzaju i ilości rozpuszczonych substancji.
Proces Rozpuszczania
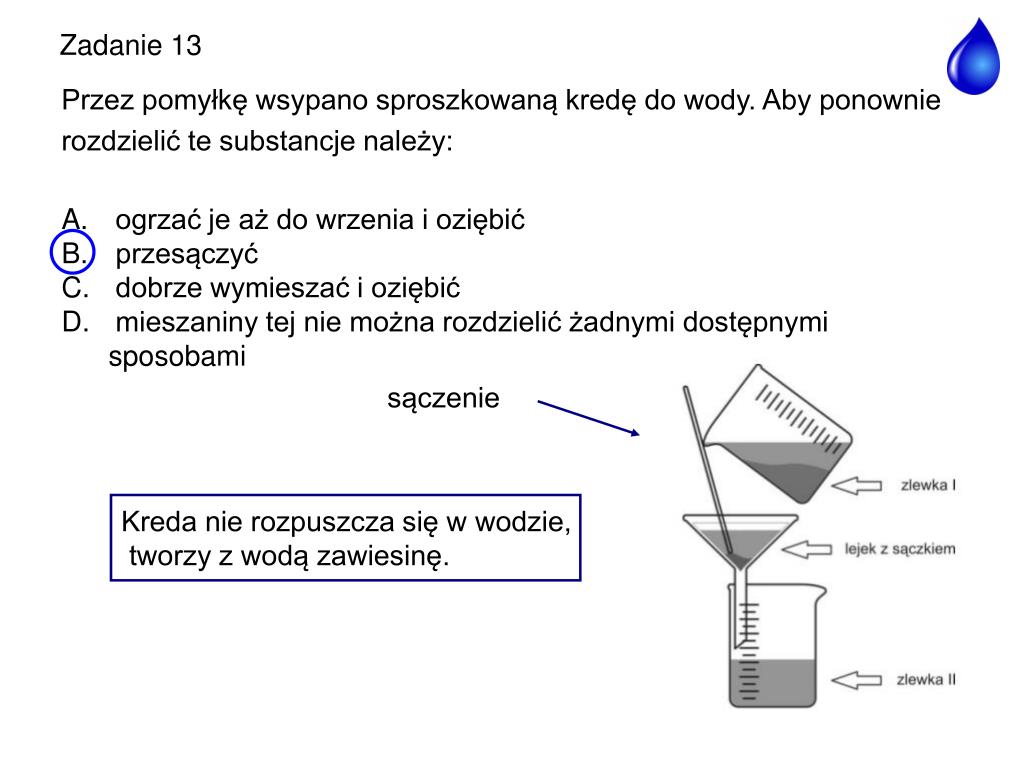
Rozpuszczanie to proces, w którym substancja rozpuszczona dysperguje się w rozpuszczalniku na poziomie molekularnym. W przypadku związków jonowych, takich jak sól kuchenna (NaCl), woda otacza jony Na+ i Cl-, neutralizując ich ładunki i oddzielając je od siebie. Ten proces nazywa się solwatacją (w przypadku wody hydratacją). Dzięki temu sól rozpuszcza się w wodzie.
Podobny proces zachodzi w przypadku substancji polarnych, takich jak alkohol. Woda tworzy wiązania wodorowe z grupami hydroksylowymi (-OH) alkoholu, co ułatwia jego rozpuszczanie. Substancje niepolarne, takie jak oleje i tłuszcze, słabo rozpuszczają się w wodzie, ponieważ nie oddziałują z nią w tak korzystny energetycznie sposób. Dlatego mówimy, że "podobne rozpuszcza podobne".
Stężenie Roztworu
Stężenie roztworu określa ilość substancji rozpuszczonej w danej ilości rozpuszczalnika lub roztworu. Istnieją różne sposoby wyrażania stężenia, w tym:
- Stężenie procentowe masowe (% m/m): Masa substancji rozpuszczonej na 100 gramów roztworu.
- Stężenie procentowe objętościowe (% V/V): Objętość substancji rozpuszczonej na 100 mililitrów roztworu.
- Stężenie molowe (mol/L): Liczba moli substancji rozpuszczonej na litr roztworu.
- Stężenie molalne (mol/kg): Liczba moli substancji rozpuszczonej na kilogram rozpuszczalnika.
Wybór odpowiedniego sposobu wyrażania stężenia zależy od konkretnego zastosowania. Stężenie molowe jest często używane w obliczeniach chemicznych, natomiast stężenie procentowe jest popularne w przemyśle spożywczym i farmaceutycznym.
Właściwości Koligatywne
Właściwości koligatywne roztworów to właściwości, które zależą od liczby cząsteczek substancji rozpuszczonej, a nie od ich rodzaju. Do najważniejszych właściwości koligatywnych należą:
- Obniżenie prężności pary rozpuszczalnika: Dodanie substancji rozpuszczonej obniża prężność pary rozpuszczalnika nad roztworem.
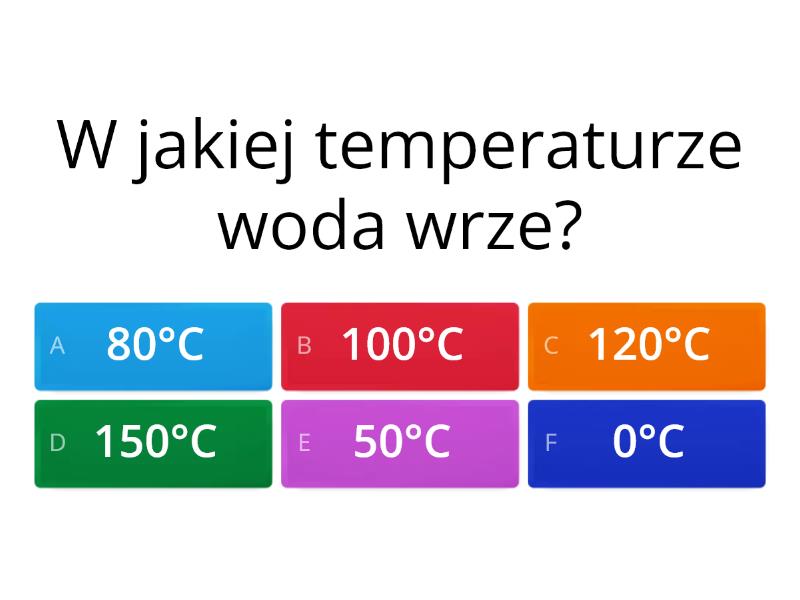
- Podwyższenie temperatury wrzenia: Temperatura wrzenia roztworu jest wyższa niż temperatura wrzenia czystego rozpuszczalnika.
- Obniżenie temperatury krzepnięcia: Temperatura krzepnięcia roztworu jest niższa niż temperatura krzepnięcia czystego rozpuszczalnika.
- Ciśnienie osmotyczne: Ciśnienie, jakie należy przyłożyć do roztworu, aby zapobiec przepływowi rozpuszczalnika przez błonę półprzepuszczalną do roztworu.
Te właściwości mają wiele zastosowań praktycznych, na przykład dodawanie soli do wody, aby obniżyć jej temperaturę krzepnięcia zimą, czy regulacja ciśnienia osmotycznego w komórkach biologicznych.
Przykłady Zastosowań Wody i Roztworów Wodnych
Woda i roztwory wodne mają szerokie zastosowanie w różnych dziedzinach życia:
- Biologia i medycyna: Woda stanowi główny składnik organizmów żywych i jest niezbędna do przebiegu większości procesów metabolicznych. Roztwory wodne, takie jak krew i limfa, transportują składniki odżywcze i tlen do komórek oraz usuwają produkty przemiany materii. Roztwory soli fizjologicznej są wykorzystywane w infuzjach do nawadniania organizmu i uzupełniania elektrolitów.
- Przemysł spożywczy: Woda jest używana jako rozpuszczalnik w produkcji napojów, żywności i leków. Roztwory wodne są wykorzystywane do konserwowania żywności, np. roztwory soli do peklowania mięsa czy roztwory cukru do konserwowania owoców.
- Przemysł chemiczny: Woda jest powszechnie stosowanym rozpuszczalnikiem w syntezie chemicznej i procesach przemysłowych. Roztwory wodne kwasów i zasad są wykorzystywane w wielu reakcjach chemicznych.
- Ochrona środowiska: Woda jest wykorzystywana do oczyszczania ścieków i usuwania zanieczyszczeń z gleby. Roztwory wodne różnych substancji chemicznych są wykorzystywane do monitorowania jakości wody i powietrza.
Dane statystyczne: Według raportu Organizacji Narodów Zjednoczonych, ponad 2 miliardy ludzi na świecie nie ma dostępu do bezpiecznej wody pitnej. To pokazuje, jak ważny jest dostęp do czystej wody i odpowiednie zarządzanie zasobami wodnymi.
Przykład z życia codziennego: Gotowanie potraw polega na rozpuszczaniu i przenoszeniu smaków w wodzie. Zupa to nic innego jak roztwór wodny różnych składników, które dają jej smak i aromat.
Podsumowanie i Wezwanie do Działania
Woda i roztwory wodne są niezwykle ważne dla życia na Ziemi i mają szerokie zastosowanie w różnych dziedzinach nauki i technologii. Zrozumienie ich właściwości i zachowania jest kluczowe dla rozwiązywania wielu problemów, z którymi się borykamy, od dostępu do czystej wody pitnej po opracowywanie nowych technologii medycznych i przemysłowych.
Zachęcam do dalszego zgłębiania wiedzy na temat wody i roztworów wodnych, do eksperymentowania i obserwowania, jak te fundamentalne substancje wpływają na nasze życie. Można zacząć od prostych eksperymentów, takich jak rozpuszczanie różnych substancji w wodzie i obserwowanie zmian temperatury, lub od analizowania składu wody w swoim otoczeniu.
Pamiętajmy również o odpowiedzialnym gospodarowaniu wodą i o dbaniu o jej czystość. Każdy z nas może przyczynić się do ochrony tego cennego zasobu poprzez oszczędzanie wody w domu, unikanie zanieczyszczania wód i wspieranie inicjatyw na rzecz ochrony środowiska.