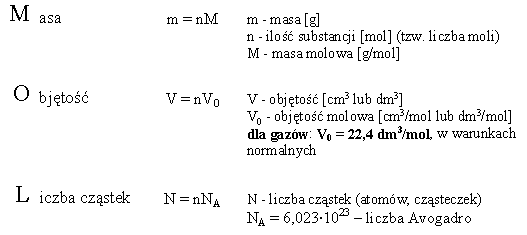Zadania Mol I Masa Molowa

W chemii, pojęcia mol i masa molowa są fundamentalne. Umożliwiają one ilościowe zrozumienie reakcji chemicznych i składu substancji. Zrozumienie tych koncepcji jest kluczowe do rozwiązywania wielu zadań obliczeniowych i interpretacji wyników eksperymentów chemicznych.
Co to jest Mol?
Mol (symbol: mol) jest jednostką miary ilości substancji w Międzynarodowym Układzie Jednostek Miar (SI). Definiuje się go jako ilość substancji, która zawiera tyle samo jednostek elementarnych (np. atomów, cząsteczek, jonów, elektronów), ile atomów znajduje się w 12 gramach izotopu węgla-12 (12C). Ta liczba, znana jako stała Avogadro (NA), wynosi około 6.022 x 1023 jednostek/mol.
Mówiąc prościej, mol jest "licznikiem" ogromnej liczby mikroskopijnych cząstek. Pozwala nam przeliczyć masę substancji, którą możemy zważyć w laboratorium, na liczbę atomów lub cząsteczek, które faktycznie biorą udział w reakcjach chemicznych.
Dlaczego używamy Mola?
Atomy i cząsteczki są niezwykle małe, więc praca z pojedynczymi atomami lub cząsteczkami jest niepraktyczna. Mol wprowadza dogodną skalę do mierzenia ilości substancji w skali makroskopowej, którą możemy z łatwością obserwować i mierzyć.
Wyobraź sobie, że chcesz zsyntetyzować wodę (H2O) z wodoru (H2) i tlenu (O2). Reakcja zachodzi w stosunku 2:1, co oznacza, że potrzebujesz dwóch cząsteczek wodoru na każdą cząsteczkę tlenu. Jednak ważenie pojedynczych cząsteczek jest niemożliwe. Używając moli, możemy łatwo odmierzyć odpowiednie masy wodoru i tlenu, aby zapewnić zajście reakcji w prawidłowym stosunku.
Co to jest Masa Molowa?
Masa molowa (symbol: M) to masa jednego mola danej substancji, wyrażona w gramach na mol (g/mol). Innymi słowy, jest to masa 6.022 x 1023 cząsteczek (lub atomów, jonów itp.) danej substancji.
Masa molowa jest numerycznie równa masie atomowej (dla pierwiastków) lub masie cząsteczkowej (dla związków), wyrażonej w jednostkach masy atomowej (u). Masa atomowa każdego pierwiastka znajduje się w układzie okresowym pierwiastków.
Obliczanie Masy Molowej
Aby obliczyć masę molową związku, należy zsumować masy atomowe wszystkich atomów wchodzących w skład cząsteczki. Na przykład:
- Woda (H2O): Dwa atomy wodoru (H) i jeden atom tlenu (O). Masa atomowa H ≈ 1.008 u, Masa atomowa O ≈ 16.00 u. Masa molowa H2O = (2 x 1.008 g/mol) + (1 x 16.00 g/mol) = 18.016 g/mol.
- Glukoza (C6H12O6): Sześć atomów węgla (C), dwanaście atomów wodoru (H) i sześć atomów tlenu (O). Masa atomowa C ≈ 12.01 u. Masa molowa C6H12O6 = (6 x 12.01 g/mol) + (12 x 1.008 g/mol) + (6 x 16.00 g/mol) = 180.156 g/mol.
Związek między Molem, Masą Molową i Masą Substancji
Istnieje prosta zależność między molem (n), masą molową (M) i masą substancji (m):
n = m / M
Gdzie:
- n = ilość substancji (w molach)
- m = masa substancji (w gramach)
- M = masa molowa substancji (w gramach/mol)
Ta formuła pozwala na przeliczanie masy substancji na liczbę moli i odwrotnie. Jest to niezwykle przydatne przy rozwiązywaniu zadań stechiometrycznych.
Zadania na Obliczanie Mola i Masy Molowej: Przykłady
Przykład 1: Ile moli znajduje się w 100 g chlorku sodu (NaCl)?
1. Oblicz masę molową NaCl: Masa atomowa Na ≈ 22.99 u, Masa atomowa Cl ≈ 35.45 u. Masa molowa NaCl = 22.99 g/mol + 35.45 g/mol = 58.44 g/mol.
2. Użyj wzoru n = m / M: n = 100 g / 58.44 g/mol = 1.71 mol.
Odpowiedź: W 100 g chlorku sodu znajduje się około 1.71 mola.
Przykład 2: Jaką masę ma 0.5 mola kwasu siarkowego (H2SO4)?
1. Oblicz masę molową H2SO4: Masa atomowa H ≈ 1.008 u, Masa atomowa S ≈ 32.07 u, Masa atomowa O ≈ 16.00 u. Masa molowa H2SO4 = (2 x 1.008 g/mol) + (1 x 32.07 g/mol) + (4 x 16.00 g/mol) = 98.086 g/mol.
2. Przekształć wzór n = m / M na m = n x M: m = 0.5 mol x 98.086 g/mol = 49.043 g.
Odpowiedź: 0.5 mola kwasu siarkowego waży około 49.043 g.
Przykład 3: Reakcja rozkładu termicznego węglanu wapnia (CaCO3) przebiega zgodnie z równaniem: CaCO3(s) → CaO(s) + CO2(g). Jeśli poddano rozkładowi 50 g CaCO3, ile moli tlenku wapnia (CaO) powstanie?
1. Oblicz masę molową CaCO3: Masa atomowa Ca ≈ 40.08 u, Masa atomowa C ≈ 12.01 u, Masa atomowa O ≈ 16.00 u. Masa molowa CaCO3 = 40.08 + 12.01 + (3 x 16.00) = 100.09 g/mol.
2. Oblicz liczbę moli CaCO3: n(CaCO3) = 50 g / 100.09 g/mol ≈ 0.5 mol.
3. Z równania reakcji wynika, że 1 mol CaCO3 daje 1 mol CaO. Zatem, jeśli rozłożono 0.5 mola CaCO3, to powstanie 0.5 mola CaO.
Odpowiedź: Powstanie 0.5 mola tlenku wapnia (CaO).
Znaczenie Mola i Masy Molowej w Chemii
Mol i masa molowa są niezbędne w wielu obliczeniach chemicznych, w tym:
- Stechiometria reakcji: Ustalanie ilości reagentów i produktów w reakcjach chemicznych.
- Obliczanie stężeń roztworów: Określanie ilości substancji rozpuszczonej w danym roztworze (np. molarność).
- Analiza elementarna: Określanie procentowego składu pierwiastkowego związku chemicznego.
- Gazy: Wykorzystanie prawa gazu doskonałego do obliczania objętości, ciśnienia i temperatury gazów.
Podsumowanie
Zrozumienie pojęć mol i masa molowa jest fundamentalne dla każdego, kto zajmuje się chemią. Pozwala to na przeliczanie masy substancji na liczbę atomów lub cząsteczek, co jest kluczowe do zrozumienia i przewidywania przebiegu reakcji chemicznych. Opanowanie tych koncepcji pozwoli na efektywne rozwiązywanie zadań stechiometrycznych i głębsze zrozumienie procesów zachodzących w świecie chemii.
Ćwicz rozwiązywanie zadań z wykorzystaniem mola i masy molowej. Im więcej praktyki, tym lepiej zrozumiesz te kluczowe pojęcia i ich zastosowania! Skorzystaj z podręczników, arkuszy ćwiczeniowych online i konsultacji z nauczycielem, aby utrwalić swoją wiedzę. Powodzenia!