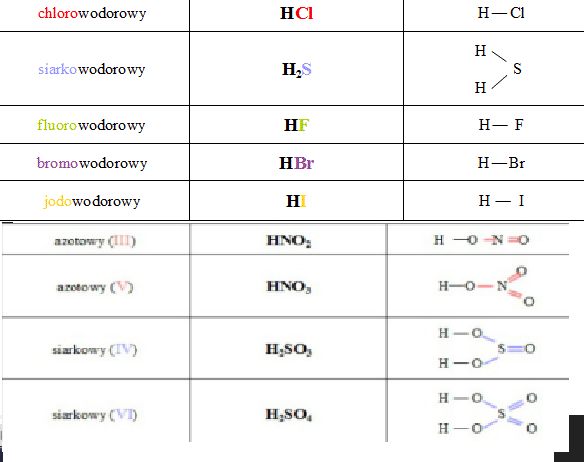
Wzory Sumaryczne I Strukturalne Klasa 7

Cześć wszystkim! Przed nami sprawdzian z wzorów sumarycznych i strukturalnych. Nie martwcie się, przygotowałem dla Was super ściągawkę, która pomoże Wam wszystko ogarnąć. Pamiętajcie, chemia jest jak język – trzeba zrozumieć zasady, a potem idzie z górki! Zaczynajmy!
Co to w ogóle są te wzory chemiczne?
Wzory chemiczne to taki skrócony sposób zapisywania, z czego zbudowane są różne substancje. Mamy dwa główne typy wzorów, które musimy znać:
Wzór sumaryczny (inaczej empiryczny)
Wzór sumaryczny, jak sama nazwa wskazuje, podaje nam *sumę* atomów każdego rodzaju, które wchodzą w skład cząsteczki. To tak, jakbyśmy robili spis ludności w malutkim państwie – interesuje nas tylko, ile jest osób danego rodzaju, a nie, jak są ułożone.
Na przykład, wzór sumaryczny wody to H2O. Co to oznacza? Mamy dwa atomy wodoru (H) i jeden atom tlenu (O) w każdej cząsteczce wody. Proste, prawda?
Kluczowe cechy wzoru sumarycznego:
- Podaje liczbę atomów każdego pierwiastka w cząsteczce.
- Nie informuje o sposobie połączenia atomów.
- Stosowany do związków jonowych i kowalencyjnych.
Wzór strukturalny
Wzór strukturalny to bardziej szczegółowy rysunek cząsteczki. Pokazuje, jak atomy są ze sobą połączone za pomocą wiązań chemicznych. Myśl o nim jak o mapie połączeń drogowych w państwie – widzisz, które miasta (atomy) są połączone ze sobą jakimi drogami (wiązaniami).
Przykład: Wzór strukturalny wody (H2O) pokazywałby, że atom tlenu (O) jest połączony z dwoma atomami wodoru (H) za pomocą dwóch kresek, które reprezentują wiązania chemiczne. Zazwyczaj rysuje się go w taki sposób: H-O-H.
Kluczowe cechy wzoru strukturalnego:
- Pokazuje, jak atomy są połączone ze sobą.
- Wskazuje rodzaje wiązań chemicznych (pojedyncze, podwójne, potrójne – im więcej kresek, tym mocniejsze wiązanie).
- Stosowany głównie do związków kowalencyjnych.
Jak pisać wzory sumaryczne?
Pisanie wzorów sumarycznych jest dość proste. Oto kilka wskazówek:
- Zidentyfikuj pierwiastki wchodzące w skład związku.
- Określ liczbę atomów każdego pierwiastka w cząsteczce.
- Zapisz symbole pierwiastków obok siebie, a liczbę atomów jako indeks dolny (mała liczba na dole po prawej stronie symbolu).
Przykład: Dwutlenek węgla składa się z jednego atomu węgla (C) i dwóch atomów tlenu (O). Jego wzór sumaryczny to CO2.
Jak pisać wzory strukturalne?
Tutaj potrzeba trochę więcej wprawy, ale bez obaw, poćwiczymy!
- Napisz symbole wszystkich atomów w cząsteczce.
- Ustal, które atomy są połączone ze sobą (często trzeba skorzystać z informacji o wartościowości pierwiastków – ile wiązań tworzy dany atom).
- Narysuj kreski (wiązania) między połączonymi atomami. Pamiętaj, że każda kreska to jedno wiązanie.
Przykład: Metan (CH4) składa się z jednego atomu węgla (C) i czterech atomów wodoru (H). Węgiel jest czterowartościowy (tworzy 4 wiązania), a wodór jest jednowartościowy (tworzy 1 wiązanie). Wzór strukturalny metanu wygląda tak:
H
|
H - C - H
|
H
Pamiętaj! Ważna jest *wartościowość*! Atom musi mieć "tyle rąk", ile wynika z jego wartościowości, żeby był "szczęśliwy" i żeby cząsteczka była stabilna.
Przykłady i Ćwiczenia
Spróbujmy kilku przykładów:
* Amoniak (NH3): Wzór sumaryczny to NH3. Wzór strukturalny (N jest trójwartościowy, H jednowartościowy):
H
|
H - N - H
* Etanol (C2H5OH): Wzór sumaryczny to C2H6O (można też zapisać jako C2H5OH, żeby podkreślić grupę hydroksylową OH). Wzór strukturalny:
H H
| |
H - C - C - O - H
| |
H H
Teraz Twoja kolej! Spróbuj napisać wzory sumaryczne i strukturalne dla następujących związków (pamiętaj o wartościowości pierwiastków!):
- Woda utleniona (H2O2)
- Chlorek sodu (NaCl)
- Metanal (CH2O)
Rozwiązania znajdziesz na końcu tego artykułu.
Różnice między wzorami a nazewnictwem
Ważne jest, żeby nie mylić wzorów z nazwami związków chemicznych. Nazwa związku opisuje go słownie, a wzór przedstawia jego skład chemiczny za pomocą symboli pierwiastków. Na przykład:
* Nazwa: Woda * Wzór sumaryczny: H2O * Wzór strukturalny: H-O-HPodsumowanie
Pamiętaj, wzory sumaryczne i strukturalne to dwa różne sposoby przedstawiania składu związków chemicznych.
* Wzór sumaryczny podaje liczbę atomów każdego pierwiastka w cząsteczce. * Wzór strukturalny pokazuje, jak atomy są połączone ze sobą. * Wartościowość pierwiastków jest kluczowa przy rysowaniu wzorów strukturalnych. * Ćwicz, ćwicz i jeszcze raz ćwicz! Im więcej będziesz pisał wzorów, tym lepiej to zrozumiesz.Powodzenia na sprawdzianie! Wierzę w Was! Nie zapominajcie o przerwach i dbajcie o pozytywne nastawienie. Jesteście w stanie to zrobić!
Rozwiązania do ćwiczeń:
- Woda utleniona (H2O2): Wzór strukturalny: H-O-O-H
- Chlorek sodu (NaCl): Związek jonowy, nie tworzy klasycznej cząsteczki, więc zazwyczaj nie rysuje się wzoru strukturalnego w tradycyjnym sensie.
- Metanal (CH2O): Wzór strukturalny:
H | C = O | H