Wzory Nazwy I Dysocjacja Soli

Czy kiedykolwiek zastanawiałeś się, co dzieje się, gdy sól kuchenna trafia do wody? Albo jak to możliwe, że niektóre roztwory przewodzą prąd, a inne nie? Odpowiedź leży w fascynującym świecie dysocjacji elektrolitycznej, procesie, który rządzi zachowaniem soli, kwasów i zasad w roztworach wodnych. To więcej niż tylko lekcja chemii – to zrozumienie, jak działa świat na poziomie molekularnym. A my, ludzie, przecież w dużej mierze składamy się z wody i rozpuszczonych w niej elektrolitów!
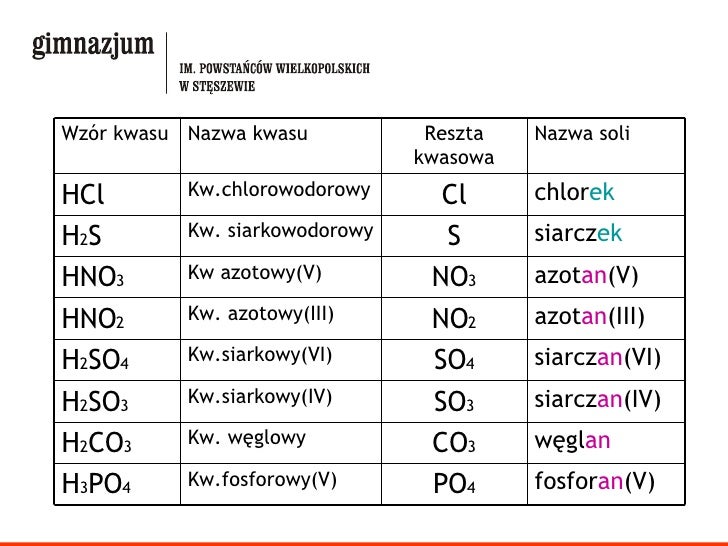
Wzory Soli – Co Musisz Wiedzieć?
Zacznijmy od podstaw: wzory soli. Każda sól to związek jonowy, składający się z kationów (jonów dodatnich, najczęściej metali) i anionów (jonów ujemnych, najczęściej reszt kwasowych). Zrozumienie wzoru soli jest kluczowe do przewidzenia jej zachowania, w tym dysocjacji.
Przykłady Wzorów Soli:
- NaCl – Chlorek sodu (sól kuchenna) – klasyczny przykład soli, gdzie kationem jest Na+ (sód), a anionem Cl- (chlorek).
- KCl – Chlorek potasu – podobnie jak NaCl, ma kation K+ (potas) i anion Cl- (chlorek).
- CaCO3 – Węglan wapnia (wapień) – kation Ca2+ (wapń) i anion CO32- (węglan).
- MgSO4 – Siarczan magnezu (sól gorzka) – kation Mg2+ (magnez) i anion SO42- (siarczan).
- Al2(SO4)3 – Siarczan glinu – kation Al3+ (glin) i anion SO42- (siarczan). Zwróć uwagę na indeksy stechiometryczne, które informują o liczbie atomów danego pierwiastka w cząsteczce.
Ważne! Wzory soli zawsze przedstawiają stosunek jonów w sieci krystalicznej, czyli w formie stałej. W roztworze wodnym sprawa jest nieco bardziej skomplikowana, o czym za chwilę.
Nazewnictwo Soli – Klucz do Zrozumienia
Nazewnictwo soli jest ściśle powiązane z ich wzorami i składnikami. Zazwyczaj nazwa składa się z dwóch części: nazwy anionu i nazwy kationu, z uwzględnieniem wartościowości metalu (jeśli ma więcej niż jedną).
Zasady Nazewnictwa:
- Anion pochodzący od kwasu beztlenowego: nazwa anionu kończy się na "-ek" (np. chlorek, siarczek, bromek).
- Anion pochodzący od kwasu tlenowego:
- Jeśli kwas kończy się na "-owy", to sól kończy się na "-an" (np. kwas siarkowy -> siarczan).
- Jeśli kwas kończy się na "-awy", to sól kończy się na "-yn" (np. kwas siarkawy -> siarczyn).
- Nazwa kationu: zwykle jest to nazwa metalu. Jeśli metal ma więcej niż jedną wartościowość, podajemy ją w nawiasie cyfrą rzymską (np. chlorek żelaza(II), chlorek żelaza(III)).
Przykłady Nazewnictwa:
- FeCl2 – Chlorek żelaza(II)
- FeCl3 – Chlorek żelaza(III)
- CuSO4 – Siarczan miedzi(II)
- NaNO3 – Azotan(V) sodu
- K2CO3 – Węglan potasu
Znajomość nazewnictwa pomaga łączyć wzór soli z jej właściwościami i zachowaniem w roztworze.
Dysocjacja Soli – Kiedy Sól Rozpada Się na Jony
Dysocjacja elektrolityczna to proces rozpadu związku jonowego (takiego jak sól) na jony pod wpływem rozpuszczalnika polarnego, takiego jak woda. Woda, dzięki swojej budowie (cząsteczka polarna), potrafi otaczać jony soli i osłabiać siły elektrostatyczne, które je wiążą w sieci krystalicznej. To jakby grupa przyjaciół (cząsteczki wody) przekonała parę (jony) do osobnych aktywności.
Jak Przebiega Dysocjacja?
- Kontakt z wodą: Kiedy sól trafia do wody, cząsteczki wody zbliżają się do powierzchni kryształu soli.
- Solwatacja: Cząsteczki wody (dzięki swojej polarności) orientują się wokół jonów soli. Koniec tlenowy (δ-) cząsteczki wody zbliża się do kationów (jonów dodatnich), a koniec wodorowy (δ+) zbliża się do anionów (jonów ujemnych). Ten proces nazywamy solwatacją (w przypadku wody – hydratacją).
- Osłabienie wiązań: Solwatacja osłabia siły elektrostatyczne wiążące jony w sieci krystalicznej.
- Rozpad: W końcu siły oddziaływania woda-jon przewyższają siły oddziaływania jon-jon, i sól rozpada się na oddzielne jony, które są otoczone przez cząsteczki wody.
Równania Dysocjacji – Zapis Procesu
Proces dysocjacji możemy zapisać za pomocą równania reakcji. Oto kilka przykładów:
- NaCl (s) → Na+ (aq) + Cl- (aq)
Sól kuchenna w stanie stałym (s) rozpada się na jony sodu (Na+) i jony chlorkowe (Cl-) w roztworze wodnym (aq). - CaCl2 (s) → Ca2+ (aq) + 2Cl- (aq)
Chlorek wapnia rozpada się na jeden jon wapnia (Ca2+) i dwa jony chlorkowe (2Cl-). Ważne! Zwróć uwagę na współczynniki stechiometryczne. - K2SO4 (s) → 2K+ (aq) + SO42- (aq)
Siarczan potasu rozpada się na dwa jony potasu (2K+) i jeden jon siarczanowy (SO42-).
(s) oznacza stan stały, a (aq) oznacza roztwór wodny (aqua).
Stopień Dysocjacji – Czy Wszystkie Sole Dysocjują Tak Samo?
Nie! Nie wszystkie sole dysocjują w 100%. Stopień dysocjacji (α) to stosunek liczby moli cząsteczek, które uległy dysocjacji, do całkowitej liczby moli cząsteczek wprowadzonych do roztworu. Wyraża się go zwykle w procentach.
Sole, które dysocjują prawie całkowicie (α bliskie 100%), nazywamy elektrolitami mocnymi. Do nich zaliczamy np. NaCl, KCl, NaOH, HCl, H2SO4. Ich roztwory bardzo dobrze przewodzą prąd elektryczny. Wyobraź sobie to jako autostradę pełną samochodów (jonów), które swobodnie się poruszają. Elektrolity mocne dysocjują jednokierunkowo (strzałka →).
Sole, które dysocjują w niewielkim stopniu (α niskie), nazywamy elektrolitami słabymi. Do nich zaliczamy np. słabe kwasy (np. CH3COOH – kwas octowy) i słabe zasady (np. NH3 – amoniak) oraz niektóre trudno rozpuszczalne sole. Ich roztwory słabo przewodzą prąd. Tutaj mamy raczej polną drogę z kilkoma autami. Elektrolity słabe dysocjują dwukierunkowo (strzałki ⇌), co oznacza, że ustala się stan równowagi między cząsteczkami niezdysocjowanymi a jonami.
Dlaczego to ważne? Stopień dysocjacji wpływa na właściwości roztworu, takie jak przewodnictwo elektryczne, ciśnienie osmotyczne i pH.
Znaczenie Dysocjacji w Życiu Codziennym
Dysocjacja elektrolityczna ma ogromne znaczenie w wielu aspektach naszego życia:
- Fizjologia: Elektrolity (jony) są niezbędne do prawidłowego funkcjonowania organizmu. Utrzymują równowagę wodno-elektrolitową, regulują pracę nerwów i mięśni, biorą udział w transporcie substancji przez błony komórkowe. Niedobór elektrolitów (np. potasu, sodu, magnezu) może prowadzić do poważnych zaburzeń. Pomyśl o napojach izotonicznych dla sportowców – uzupełniają one elektrolity utracone podczas wysiłku.
- Rolnictwo: Nawozy zawierają sole, które po rozpuszczeniu w wodzie dostarczają roślinom niezbędne jony (np. azotany, fosforany, potas).
- Przemysł: Elektroliza (proces wykorzystujący dysocjację elektrolityczną do przeprowadzania reakcji chemicznych) jest wykorzystywana w produkcji wielu substancji, takich jak chlor, sód, aluminium.
- Oczyszczanie wody: Procesy koagulacji i flokulacji, stosowane w oczyszczalniach ścieków, wykorzystują sole do usuwania zanieczyszczeń z wody.
- Akumulatory: Działanie akumulatorów opiera się na procesach chemicznych zachodzących dzięki obecności elektrolitów (roztworów kwasów, zasad lub soli).
Counterpoint: Czy Zawsze Dysocjacja Zachodzi?
Choć dysocjacja jest powszechnym zjawiskiem, to nie zawsze zachodzi. Jak wspomniano, niektóre sole są trudno rozpuszczalne i dysocjują w bardzo niewielkim stopniu. Ponadto, istnieją związki kowalencyjne (niejonowe), które nie ulegają dysocjacji w wodzie, np. cukier (sacharoza). Cukier rozpuszcza się w wodzie, ale nie rozpada się na jony. To dlatego roztwór cukru nie przewodzi prądu elektrycznego.
Warto też wspomnieć o zjawisku asocjacji jonowej, które może zachodzić w roztworach stężonych. W takich roztworach, jony mogą łączyć się ze sobą, tworząc pary jonowe lub większe agregaty, co zmniejsza efektywną liczbę jonów w roztworze i wpływa na jego właściwości.
Co Zatem Robić? – Podsumowanie i Wskazówki
Zrozumienie wzorów, nazw i dysocjacji soli to klucz do sukcesu w chemii. Oto kilka wskazówek, które mogą Ci pomóc:
- Ćwicz nazewnictwo i pisanie wzorów soli. Im więcej ćwiczysz, tym łatwiej zapamiętasz zasady.
- Zrozum ideę polarności cząsteczek wody. To podstawa do zrozumienia, dlaczego dysocjacja zachodzi.
- Zapamiętaj przykłady elektrolitów mocnych i słabych. To ułatwi przewidywanie właściwości roztworów.
- Analizuj równania dysocjacji. Zwracaj uwagę na współczynniki stechiometryczne i ładunki jonów.
- Pamiętaj o praktycznym znaczeniu dysocjacji. To pomoże Ci zrozumieć, dlaczego chemia jest ważna w życiu codziennym.
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć fascynujący świat soli i ich zachowania w roztworach. Czy teraz, patrząc na szklankę wody z solą, widzisz coś więcej niż tylko prosty roztwór? Może dostrzegasz dynamiczny świat jonów otoczonych przez cząsteczki wody, świat, który ma ogromny wpływ na nasze życie?