Wzory Kwasów Tlenowych I Beztlenowych
Hej! Przygotuj się na chemiczną przygodę! Dziś rozpracujemy kwasy. Brzmi strasznie? Bez obaw! Użyjemy supermocy wyobraźni i wszystko stanie się jasne jak słońce w bezchmurny dzień. Zapomnij o nudnych wzorach – my tu bawimy się chemią!
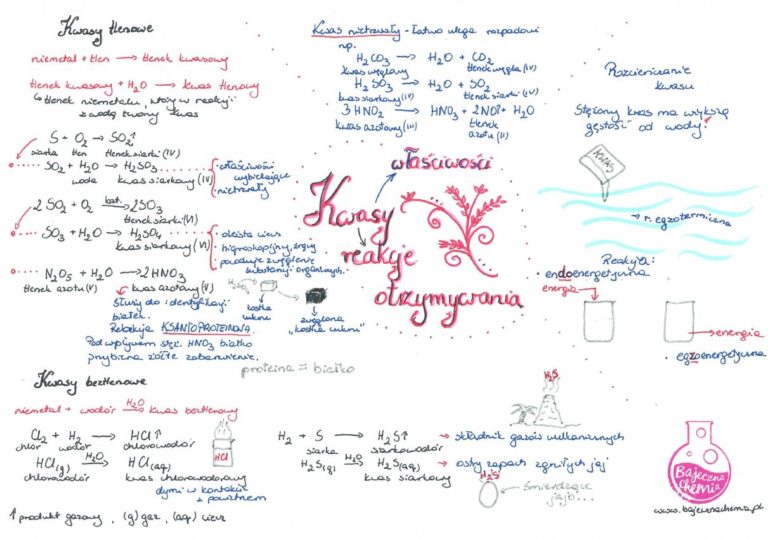
Kwasy dzielimy na dwie główne ekipy: kwasy tlenowe i kwasy beztlenowe. Pomyśl o tym jak o podziale na drużynę "tlenowców" i "beztlenowców". Zgadnij, co różni te drużyny? Bingo! Tlen! Tlenowcy mają go w swoim składzie, a beztlenowcy... no, nie mają.
Drużyna "Tlenowcy" – Królowie Tlenu!
Kwasy tlenowe, ach, te kwasy! Wyobraź sobie, że każdy kwas to taka mała, chemiczna orkiestra. W tej orkiestrze mamy centralny element, czyli atom niemetalu (np. siarka, azot, chlor). Do tego dochodzą atomy tlenu – takie małe, energetyczne skrzypce, które dodają mocy całej kompozycji. I oczywiście, mamy jeszcze wodór, który gra rolę dyrygenta, trzymając wszystko w ryzach. Przykład? Proszę bardzo:
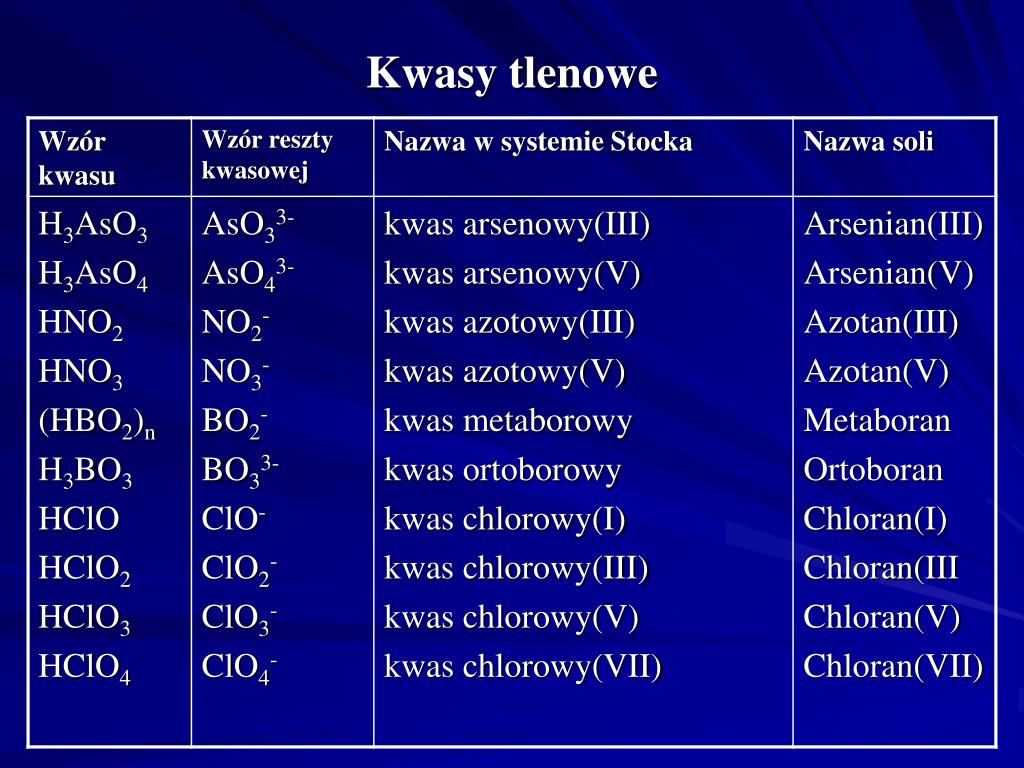
H2SO4 – Kwas Siarkowy (VI) – Król Kwasów!
Kwas siarkowy to prawdziwy król. Używany wszędzie, od produkcji nawozów, przez oczyszczanie ścieków, aż po akumulatory samochodowe. To taki chemiczny MacGyver – do wszystkiego się przyda! Formuła H2SO4 mówi nam: dwa atomy wodoru, jeden atom siarki i cztery atomy tlenu. Proste, prawda? Pomyśl o tym jak o przepisie na supermocny napój (tylko broń Boże nie pij go!).
HNO3 – Kwas Azotowy (V) – Dynamit Chemii!
Kwas azotowy to z kolei trochę taki chemik-pirotechnik. Potrafi nieźle namieszać (dosłownie!). Jest składnikiem nawozów sztucznych, ale i materiałów wybuchowych. Jego formuła, HNO3, mówi nam: jeden wodór, jeden azot i trzy tleny. Krótko, zwięźle i na temat – jak materiał wybuchowy gotowy do akcji!
Zapamiętaj: kwasy tlenowe mają w nazwie cyfrę rzymską! To tak, jakby miały tytuł szlachecki. Kwas Siarkowy (VI), Kwas Azotowy (V) – brzmi dumnie, prawda?
Drużyna "Beztlenowcy" – Bez Tlenu, Ale Z Pazurem!
Kwasy beztlenowe to twardziele. Oni nie potrzebują tlenu, żeby robić swoje. Są proste, ale potężne. Tutaj mamy atom wodoru i atom niemetalu (np. chlor, siarkowodór). Bez żadnych ceregieli! Przykład?
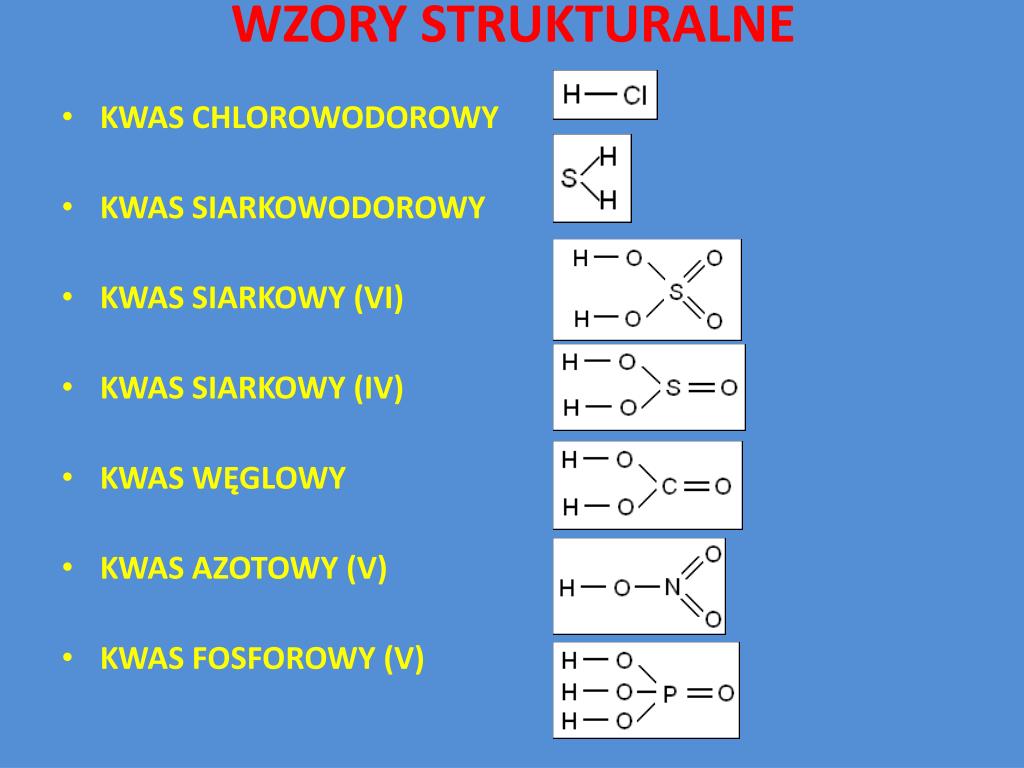
HCl – Kwas Chlorowodorowy – Ukryty As w Żołądku!
Kwas chlorowodorowy to taki cichy bohater naszego organizmu. Znajdziesz go... w żołądku! Pomaga trawić jedzenie, rozkładając białka na mniejsze kawałeczki. Dzięki niemu możemy cieszyć się pysznym obiadem! Formuła HCl to po prostu jeden atom wodoru i jeden atom chloru. Krótko i na temat – jak beztlenowy mistrz sztuk walki!
H2S – Kwas Siarkowodorowy – Zapachowa Petarda!
Kwas siarkowodorowy to... cóż, to ten kwas, który odpowiada za zapach zgniłych jaj! Tak, ten nieprzyjemny aromat, który czujesz, gdy coś zaczyna się psuć. H2S to dwa atomy wodoru i jeden atom siarki. Niby proste, a potrafi narobić zamieszania (szczególnie w zamkniętych pomieszczeniach!).
Kwasy beztlenowe nie mają w nazwie cyfr rzymskich. Są bardziej... bezpośrednie. Kwas Chlorowodorowy, Kwas Siarkowodorowy – po prostu mówią, co w nich siedzi.
Pamiętaj! Kwasy to potężne substancje. Nigdy, przenigdy nie baw się nimi sam! Zawsze rób to pod okiem doświadczonego chemika (albo kogoś, kto zna się na rzeczy!).
I to by było na tyle! Mam nadzieję, że polubiliście kwasy tak samo jak ja. Teraz możecie brylować wiedzą o kwasach tlenowych i beztlenowych i zaskakiwać wszystkich swoją chemiczną wiedzą! Bawcie się chemią i pamiętajcie – eksperymenty to świetna zabawa, ale zawsze róbcie to bezpiecznie!

.jpg)