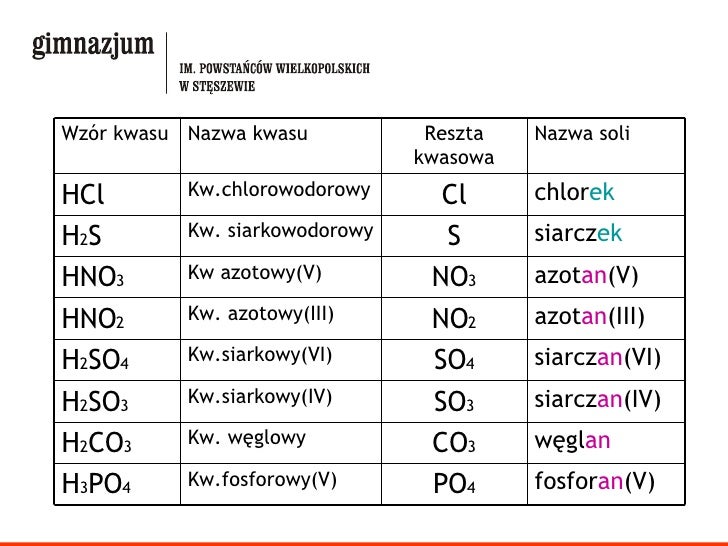
Wzory I Nazwy Soli Zadania

Czy kiedykolwiek zastanawiałeś się, dlaczego sól kuchenna ma taki, a nie inny wzór? Albo dlaczego jedne sole rozpuszczają się w wodzie lepiej od innych? Jeśli tak, to dobrze trafiłeś! Nauka o solach, a w szczególności ich wzory i nazewnictwo, może wydawać się z początku skomplikowana, ale w rzeczywistości kryje się za nią sporo logiki i praktycznego zastosowania. W tym artykule rozłożymy ten temat na czynniki pierwsze, abyś zrozumiał/a, jak tworzyć i odczytywać wzory soli, oraz jak je poprawnie nazywać.
Czym są sole i dlaczego są ważne?
Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Charakterystyczne dla nich jest to, że składają się z kationu metalu (lub kationu amonu) i anionu reszty kwasowej. Sole są wszechobecne w naszym otoczeniu – od soli kuchennej (chlorku sodu) używanej w kuchni, po sole mineralne znajdujące się w wodach i glebie, niezbędne dla życia roślin i zwierząt.
Dlaczego są ważne? Sole pełnią wiele istotnych funkcji, m.in.:
- Uczestniczą w procesach fizjologicznych (np. przewodnictwo nerwowe, utrzymanie równowagi elektrolitowej).
- Są wykorzystywane w przemyśle (np. produkcja nawozów, leków, materiałów budowlanych).
- Są składnikami żywności (np. konserwanty, wzmacniacze smaku).
Wzory soli: Jak je tworzyć i odczytywać?
Zrozumienie wzoru chemicznego soli jest kluczowe do identyfikacji danego związku i przewidywania jego właściwości. Wzór soli składa się z symboli pierwiastków, które wchodzą w jej skład, oraz indeksów stechiometrycznych, które określają stosunek ilościowy poszczególnych pierwiastków.
Krok 1: Identyfikacja kationu i anionu
Najpierw musimy zidentyfikować kation (jon o ładunku dodatnim) i anion (jon o ładunku ujemnym) wchodzące w skład soli. Kation pochodzi zazwyczaj od metalu (np. Na+, Ca2+, Al3+) lub jonu amonowego (NH4+), natomiast anion pochodzi od reszty kwasowej (np. Cl-, SO42-, NO3-).
Przykład: W chlorku sodu (NaCl) kationem jest jon sodu (Na+), a anionem jest jon chlorkowy (Cl-).
Krok 2: Określenie wartościowości
Następnie musimy określić wartościowość kationu i anionu. Wartościowość to liczba ładunków, które dany jon posiada. Znajomość wartościowości jest niezbędna do prawidłowego zbilansowania ładunków w związku chemicznym.
Przykład: Jon sodu (Na+) ma wartościowość I, ponieważ ma ładunek +1. Jon chlorkowy (Cl-) ma wartościowość I, ponieważ ma ładunek -1. Jon wapnia (Ca2+) ma wartościowość II, a jon siarczanowy (SO42-) również ma wartościowość II.
Krok 3: Zbilansowanie ładunków
Kluczowe jest, aby suma ładunków dodatnich i ujemnych w związku chemicznym wynosiła zero. Jeśli wartościowości kationu i anionu są różne, musimy użyć odpowiednich indeksów stechiometrycznych, aby zbilansować ładunki.
Przykład 1: Chlorek sodu (NaCl). Jon sodu (Na+) ma wartościowość I, a jon chlorkowy (Cl-) ma wartościowość I. Ładunki są już zbilansowane (+1 i -1), więc wzór soli to NaCl.
Przykład 2: Chlorek wapnia (CaCl2). Jon wapnia (Ca2+) ma wartościowość II, a jon chlorkowy (Cl-) ma wartościowość I. Aby zbilansować ładunki, potrzebujemy dwóch jonów chlorkowych na jeden jon wapnia. Dlatego wzór soli to CaCl2 (+2 i 2x-1 = -2).
Przykład 3: Siarczan glinu (Al2(SO4)3). Jon glinu (Al3+) ma wartościowość III, a jon siarczanowy (SO42-) ma wartościowość II. Aby zbilansować ładunki, potrzebujemy dwóch jonów glinu (2 x +3 = +6) i trzech jonów siarczanowych (3 x -2 = -6). Dlatego wzór soli to Al2(SO4)3.
Nazewnictwo soli: Systematyczne i tradycyjne nazwy
Oprócz wzorów chemicznych, sole mają również nazwy. Istnieją dwa główne systemy nazewnictwa soli: systematyczny i tradycyjny. Systematyczne nazwy są bardziej precyzyjne i zgodne z zasadami nazewnictwa chemicznego, natomiast tradycyjne nazwy są często krótsze i bardziej powszechne, ale mniej informatywne.
Nazewnictwo systematyczne
W nazewnictwie systematycznym nazwa soli składa się z dwóch części: nazwy anionu (reszty kwasowej) i nazwy kationu (metalu), przy czym najpierw podajemy nazwę anionu.
Przykłady:
- NaCl: chlorek sodu
- CaCO3: węglan wapnia
- KNO3: azotan potasu
- FeSO4: siarczan żelaza(II) - *uwaga na rzymską cyfrę oznaczającą wartościowość żelaza*
W przypadku metali, które mogą występować na różnych stopniach utlenienia (czyli mieć różną wartościowość), po nazwie metalu w nawiasie podajemy rzymską cyfrę oznaczającą jego wartościowość. Jest to bardzo ważne, aby odróżnić np. chlorek żelaza(II) (FeCl2) od chlorku żelaza(III) (FeCl3).
Nazewnictwo tradycyjne
Nazewnictwo tradycyjne jest mniej precyzyjne i często opiera się na historycznych nazwach lub pochodzeniu danej soli. W tym systemie nazwy soli tworzy się, dodając do nazwy anionu końcówkę "-ek" i nazwę kationu w dopełniaczu.
Przykłady:
- NaCl: sól kuchenna (chlorek sodu)
- CaCO3: wapniak (węglan wapnia)
- Na2CO3: soda (węglan sodu)
Nazewnictwo tradycyjne jest często używane w życiu codziennym i w niektórych gałęziach przemysłu, ale w naukach chemicznych preferowane jest nazewnictwo systematyczne, ponieważ jest bardziej jednoznaczne i precyzyjne.
Przykłady i zadania do samodzielnego rozwiązania
Aby utrwalić wiedzę, przeanalizujmy kilka przykładów i spróbujmy samodzielnie rozwiązać zadania:
Przykład 1: Fluorek potasu (KF)
Kation: K+ (potas, wartościowość I)
Anion: F- (fluorek, wartościowość I)
Wzór: KF (ładunki zbilansowane)
Przykład 2: Fosforan wapnia (Ca3(PO4)2)
Kation: Ca2+ (wapń, wartościowość II)
Anion: PO43- (fosforan, wartościowość III)
Wzór: Ca3(PO4)2 (potrzebujemy 3 jony wapnia (3 x +2 = +6) i 2 jony fosforanowe (2 x -3 = -6), aby zbilansować ładunki)
Zadania do samodzielnego rozwiązania:
- Napisz wzory następujących soli:
- Siarczan miedzi(II)
- Azotan glinu
- Węglan potasu
- Podaj nazwy systematyczne następujących soli:
- MgBr2
- AgNO3
- Fe2(SO4)3
Sprawdź swoje odpowiedzi:
-
- Siarczan miedzi(II): CuSO4
- Azotan glinu: Al(NO3)3
- Węglan potasu: K2CO3
-
- MgBr2: bromek magnezu
- AgNO3: azotan srebra(I) (lub po prostu azotan srebra)
- Fe2(SO4)3: siarczan żelaza(III)
Podsumowanie
Zrozumienie wzorów i nazewnictwa soli jest fundamentem chemii. Pamiętaj, że kluczem do sukcesu jest: identyfikacja kationu i anionu, określenie wartościowości, zbilansowanie ładunków i poprawne zastosowanie zasad nazewnictwa systematycznego. Ćwicz regularnie, rozwiązuj zadania i nie bój się pytać, jeśli coś jest niejasne. Powodzenia!