Wzory I Nazwy Soli Klasa 8
Czy kiedykolwiek zastanawiałeś się, co kryje się za tajemniczymi nazwami substancji chemicznych, które spotykasz na lekcjach chemii? Dla wielu uczniów klasy 8, wzory i nazwy soli mogą wydawać się prawdziwą zagadką. To zrozumiałe! Chemia, choć fascynująca, potrafi być wymagająca, zwłaszcza na początku przygody z tym przedmiotem. Ale nie martw się, jesteśmy tu, aby to zmienić!
Ten artykuł ma na celu przystępne wyjaśnienie zagadnień związanych z solami, tak aby każdy uczeń klasy 8 mógł zrozumieć ich strukturę, nazewnictwo i rolę w otaczającym nas świecie. Postaramy się unikać trudnego języka i skupić się na praktycznych przykładach, które pomogą Ci zapamiętać najważniejsze informacje.
Czym są Sole? Podstawowe Informacje
Zacznijmy od podstaw. Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Proces ten nazywamy reakcją zobojętniania. Prościej mówiąc, sole to produkty, które otrzymujemy, gdy kwas reaguje z zasadą, neutralizując się nawzajem.
Sole składają się z:
- Kationu metalu (lub jonu amonowego NH4+) – jon o ładunku dodatnim.
- Anionu reszty kwasowej – jon o ładunku ujemnym, pochodzący od kwasu.
Przykład: NaCl (chlorek sodu) – sól kuchenna. Kationem jest tutaj jon sodu (Na+), a anionem jest jon chlorkowy (Cl-).
Ważne: Istnieją też sole, które nie powstają w wyniku reakcji zobojętniania, ale np. w reakcji metalu z kwasem lub tlenkiem kwasowym z zasadą. Jednak na poziomie klasy 8, reakcja zobojętniania jest najczęściej omawiana.
Wzory Soli – Jak Je Zapisywać?
Zapisywanie wzorów soli opiera się na znajomości wartościowości pierwiastków i reszt kwasowych. Wartościowość to liczba wiązań, które dany atom lub grupa atomów może utworzyć z innymi atomami.
Krok po kroku:
- Zidentyfikuj kation i anion. Określ, jaki metal (lub jon amonowy) i jaka reszta kwasowa wchodzą w skład soli.
- Określ wartościowość kationu i anionu. Wartościowość kationu zazwyczaj odpowiada liczbie elektronów walencyjnych metalu. Wartościowość anionu wynika z liczby atomów wodoru, które zostały odłączone od kwasu.
- Zapisz symbol kationu, a następnie symbol anionu. Np. MgCl.
- Ustal indeksy stechiometryczne (liczby w indeksie dolnym). Jeśli wartościowości kationu i anionu są równe, to indeksy wynoszą 1 (i zazwyczaj się ich nie zapisuje). Jeśli wartościowości są różne, należy je zamienić miejscami i zapisać jako indeksy.
Przykład 1: Chlorek magnezu (MgCl2)
- Kation: Mg2+ (magnez, wartościowość II)
- Anion: Cl- (chlorek, wartościowość I)
- Zamieniamy wartościowości: Mg1Cl2
- Ostateczny wzór: MgCl2
Przykład 2: Siarczan glinu (Al2(SO4)3)
- Kation: Al3+ (glin, wartościowość III)
- Anion: SO42- (siarczan, wartościowość II)
- Zamieniamy wartościowości: Al2(SO4)3
- Ostateczny wzór: Al2(SO4)3
Pamiętaj: Jeśli reszta kwasowa jest grupą atomów (np. SO42-, PO43-), to całą grupę umieszczamy w nawiasie, a indeks piszemy za nawiasem.
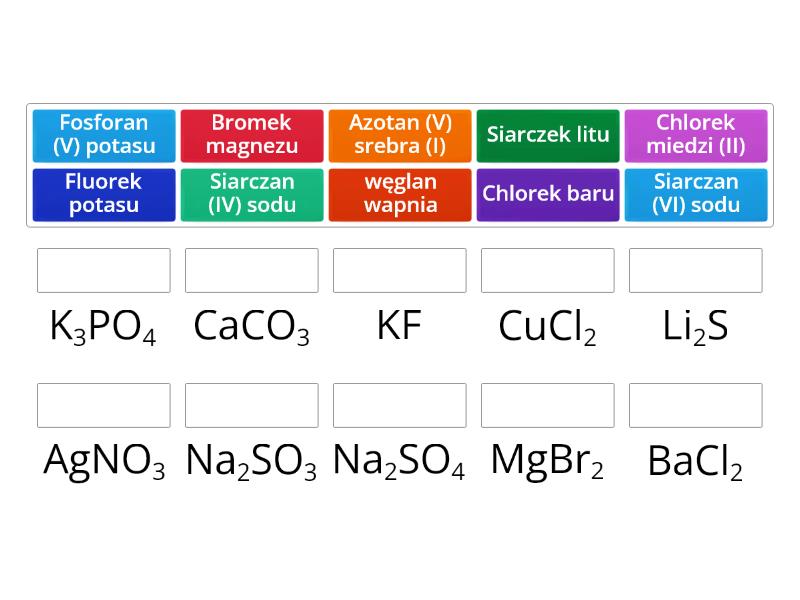
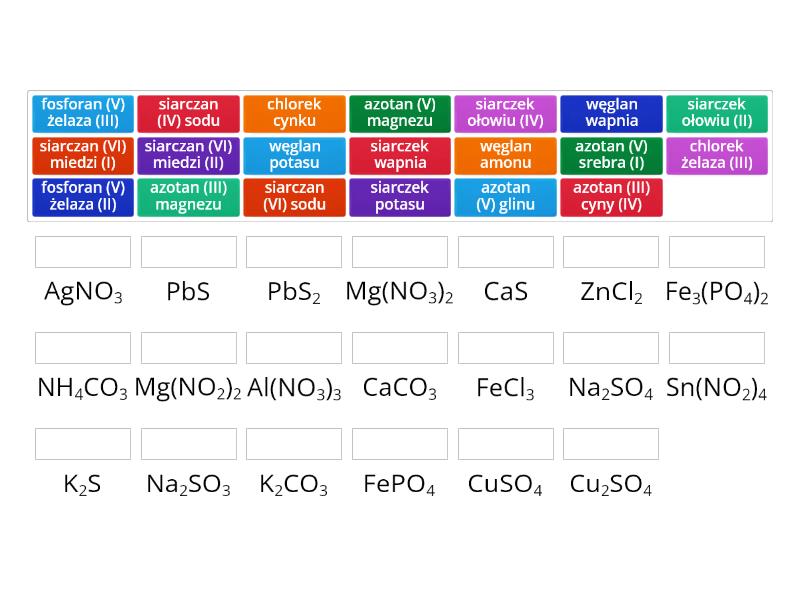
Nazewnictwo Soli – Jak Czytać i Tworzyć Nazwy?
Nazwa soli składa się z dwóch części: nazwy anionu (reszty kwasowej) i nazwy kationu (metalu), przy czym najpierw podajemy nazwę anionu.
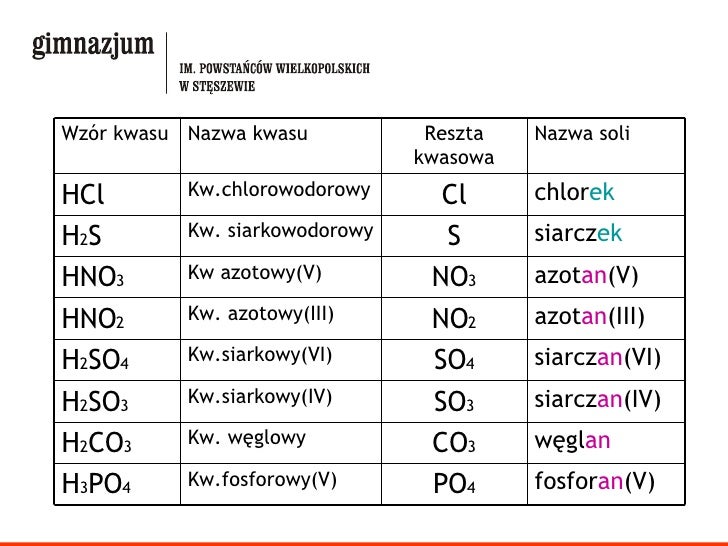
Nazwy anionów pochodzą od nazw kwasów:
- Kwasy beztlenowe (np. HCl) tworzą sole o nazwach zakończonych na "-ek": chlorek, fluorek, bromek, jodek, siarczek.
- Kwasy tlenowe (np. H2SO4) tworzą sole o nazwach zakończonych na "-an": siarczan, azotan, fosforan, węglan.
Nazwy kationów pochodzą od nazw metali:
- Metale o jednej wartościowości (np. sód, potas, wapń) mają nazwy takie same jak nazwa metalu.
- Metale o zmiennej wartościowości (np. żelazo, miedź, chrom) wymagają podania wartościowości w nawiasie cyframi rzymskimi po nazwie metalu. Np. chlorek żelaza(II), chlorek żelaza(III).
Przykłady:
- NaCl – chlorek sodu
- CaCO3 – węglan wapnia
- FeCl2 – chlorek żelaza(II)
- FeCl3 – chlorek żelaza(III)
- CuSO4 – siarczan miedzi(II)
- KNO3 – azotan potasu
Sole proste i sole kwaśne
Oprócz soli obojętnych, o których mówiliśmy wcześniej, istnieją także sole kwaśne i sole zasadowe. W klasie 8 najczęściej omawiane są sole kwaśne, więc na nich się skupimy.
Sole kwaśne powstają, gdy nie wszystkie atomy wodoru w kwasie zostają zastąpione przez metal. W ich nazwach pojawia się przedrostek "wodoroo-".
Przykład: NaHCO3 – wodorowęglan sodu (soda oczyszczona). W kwasie węglowym (H2CO3) tylko jeden atom wodoru został zastąpiony przez atom sodu.
Praktyczne Wskazówki i Sztuczki
Jak zapamiętać nazwy kwasów i odpowiadające im reszty kwasowe?
- Stwórz tabelę z nazwami kwasów i reszt kwasowych. Powtarzaj ją regularnie.
- Używaj kart flash. Na jednej stronie zapisz wzór kwasu, a na drugiej nazwę reszty kwasowej.
- Rozwiązuj zadania. Im więcej przykładów przeanalizujesz, tym lepiej zapamiętasz zasady nazewnictwa.
Jak ustalić wartościowość metalu o zmiennej wartościowości?
- Zwróć uwagę na indeks anionu. Wartościowość metalu jest często równa temu indeksowi.
- Sprawdź, czy suma ładunków kationów i anionów w soli wynosi zero.
Pamiętaj: Chemia wymaga systematycznej pracy i powtarzania. Nie zrażaj się, jeśli na początku coś wydaje Ci się trudne. Z czasem wszystko stanie się bardziej jasne.
Dlaczego Sole są Ważne?
Sole odgrywają niezwykle ważną rolę w naszym życiu i w przemyśle. Oto kilka przykładów:
- Sól kuchenna (NaCl) – niezbędna do życia, używana jako przyprawa i konserwant.
- Węglan wapnia (CaCO3) – składnik wapienia, marmuru i kredy, używany w budownictwie i przemyśle cementowym.
- Siarczan magnezu (MgSO4) – stosowany jako lek przeczyszczający i w rolnictwie jako nawóz.
- Azotan potasu (KNO3) – składnik nawozów sztucznych i prochu strzelniczego.
Znajomość wzorów i nazw soli pozwala nam zrozumieć skład i właściwości wielu substancji, które nas otaczają. To klucz do zrozumienia chemii i jej roli w świecie.
Mamy nadzieję, że ten artykuł pomógł Ci zrozumieć wzory i nazwy soli. Pamiętaj, że nauka chemii to proces. Im więcej będziesz ćwiczyć i zadawać pytań, tym lepiej zrozumiesz ten fascynujący przedmiot. Powodzenia!