Wzory I Nazwy Soli Kartkówka
Chemia to fascynująca dziedzina nauki, a jednym z jej kluczowych elementów jest zrozumienie soli. Związki te, obecne w naszym codziennym życiu, od kuchni po przemysł, odgrywają niezmiernie ważną rolę. Niniejszy artykuł ma na celu przybliżenie zagadnienia wzorów i nazw soli, ze szczególnym naciskiem na przygotowanie do kartkówki z tego zakresu. Zatem, przygotujmy się na podróż po świecie soli, która pozwoli Ci zrozumieć ich strukturę, nazewnictwo i znaczenie.
Wprowadzenie do Soli
Sól, w kontekście chemicznym, to związek chemiczny powstały w wyniku reakcji zobojętniania, czyli reakcji kwasu z zasadą. W wyniku tej reakcji, jony wodorowe (H+) kwasu zostają zastąpione jonami metalu (lub grupą amonową, NH4+) pochodzącą z zasady, a jony wodorotlenkowe (OH-) z zasady zostają zastąpione anionem reszty kwasowej. W efekcie powstaje sól i woda.
Podział Soli
Soli można podzielić na kilka typów, w zależności od stopnia zastąpienia jonów wodorowych w kwasie lub jonów wodorotlenkowych w zasadzie:
- Sole obojętne: Wszystkie jony wodorowe w kwasie zostały zastąpione przez jony metalu. Przykład: NaCl (chlorek sodu).
- Sole kwaśne (wodorosole): Nie wszystkie jony wodorowe w kwasie zostały zastąpione przez jony metalu. Przykład: NaHCO3 (wodorowęglan sodu).
- Sole zasadowe (hydroksosole): Nie wszystkie jony wodorotlenkowe w zasadzie zostały zastąpione przez aniony reszty kwasowej. Przykład: Mg(OH)Cl (hydroksychlorek magnezu).
- Sole podwójne: Zawierają dwa różne kationy. Przykład: KAl(SO4)2 (ałun potasowo-glinowy).
- Sole uwodnione (hydraty): Zawierają w swojej strukturze cząsteczki wody. Przykład: CuSO4·5H2O (pentahydrat siarczanu(VI) miedzi(II)).
Tworzenie Wzorów Soli
Aby poprawnie zapisać wzór soli, należy znać wzory i wartościowości kationu (jonu metalu) i anionu (reszty kwasowej). Wartościowość to liczba wiązań, jakie atom może utworzyć. Znając wartościowości, możemy ustalić proporcję, w jakiej kation i anion łączą się, aby cały związek był elektrycznie obojętny.
Krok po Kroku do Poprawnego Wzoru
- Określ kation i anion: Zidentyfikuj metal (kation) i resztę kwasową (anion).
- Zapisz symbole: Zapisz symbol kationu, a następnie symbol anionu.
- Określ wartościowości: Ustal wartościowość kationu i anionu. Wartościowość kationu zazwyczaj odpowiada liczbie elektronów walencyjnych metalu, a wartościowość anionu wynika z liczby usuniętych jonów wodorowych z kwasu.
- Skrzyżuj wartościowości: Wartościowość kationu staje się indeksem anionu, a wartościowość anionu staje się indeksem kationu.
- Uprość indeksy: Jeśli to możliwe, uprość indeksy, dzieląc je przez największy wspólny dzielnik.
- Umieść w nawiasach reszty wieloatomowe: Jeśli anion jest wieloatomowy i jego indeks jest większy niż 1, umieść go w nawiasach.
Przykład: Chlorek glinu.
Glin (Al) – kation, wartościowość III
Chlorek (Cl) – anion, wartościowość I
Wzór: AlCl3
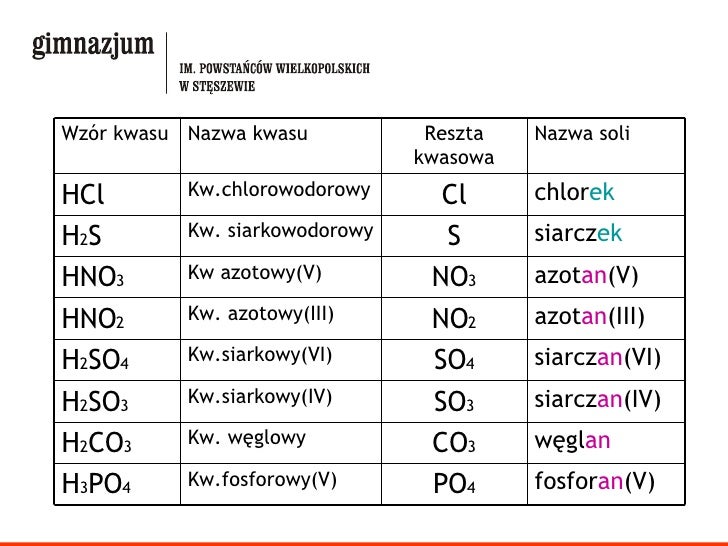
Nazewnictwo Soli
Nazwa soli składa się z dwóch części: nazwy anionu (reszty kwasowej) i nazwy kationu (metalu). W nazewnictwie należy uwzględnić wartościowość metalu, jeśli występuje on na różnych stopniach utlenienia.
Zasady Nazewnictwa
- Nazwa anionu: Nazwa anionu pochodzi od nazwy kwasu, z którego powstał.
- Kwasy beztlenowe: dodajemy końcówkę "-ek". Na przykład, HCl to kwas chlorowodorowy, a Cl- to chlorek.
- Kwasy tlenowe:
- Kwasy o wyższej wartościowości centralnego atomu: końcówka "-an". Na przykład, H2SO4 to kwas siarkowy(VI), a SO42- to siarczan(VI).
- Kwasy o niższej wartościowości centralnego atomu: końcówka "-yn". Na przykład, H2SO3 to kwas siarkowy(IV), a SO32- to siarczan(IV).
- Nazwa kationu: Nazwa kationu pochodzi od nazwy metalu. Jeśli metal ma więcej niż jedną wartościowość, należy ją podać w nawiasie po nazwie metalu, używając cyfr rzymskich.
Przykłady:
- NaCl: chlorek sodu
- FeCl2: chlorek żelaza(II)
- FeCl3: chlorek żelaza(III)
- CaSO4: siarczan(VI) wapnia
- CuSO3: siarczan(IV) miedzi(II)
Wyjątki i Utrwalone Nazwy
Istnieją pewne wyjątki i utrwalone nazwy, które warto zapamiętać:
- Woda królewska: Mieszanina stężonego kwasu azotowego(V) i kwasu chlorowodorowego w stosunku molowym 1:3.
- Amoniak: NH3
- Wapno palone: CaO (tlenek wapnia)
- Wapno gaszone: Ca(OH)2 (wodorotlenek wapnia)
- Soda oczyszczona: NaHCO3 (wodorowęglan sodu)
- Soda kalcynowana: Na2CO3 (węglan sodu)
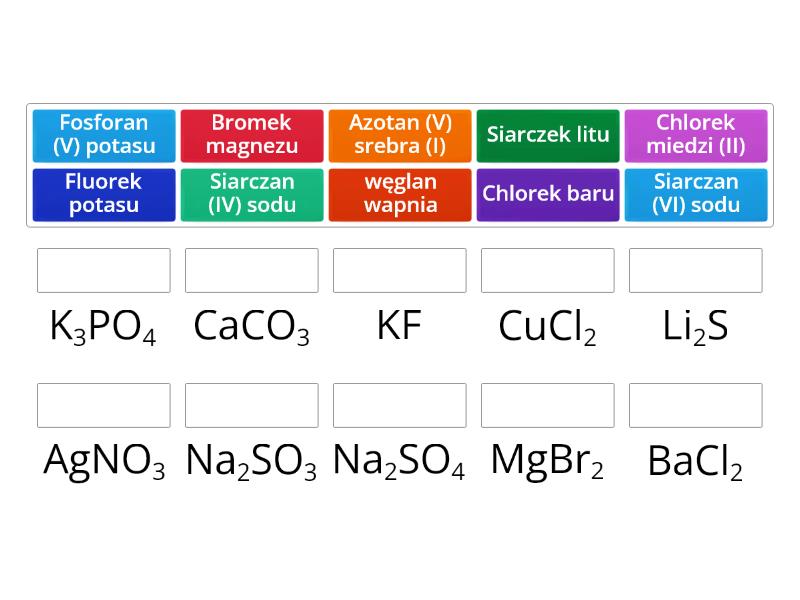
Przykłady i Ćwiczenia Praktyczne
Aby utrwalić wiedzę, warto rozwiązać kilka ćwiczeń praktycznych. Spróbuj samodzielnie ustalić wzory i nazwy następujących soli:
- Siarczan(VI) potasu
- Azotan(V) magnezu
- Węglan wapnia
- Fosforan(V) żelaza(III)
- Bromek glinu
Rozwiązania:
- K2SO4
- Mg(NO3)2
- CaCO3
- FePO4
- AlBr3
Znaczenie Soli w Życiu Codziennym i Przemysłowym
Soli odgrywają kluczową rolę w wielu aspektach naszego życia. Od chlorku sodu (soli kuchennej), który jest niezbędny do funkcjonowania organizmu i przyprawiania potraw, po węglan wapnia (składnik wapienia i marmuru), który jest ważnym materiałem budowlanym. W przemyśle, sole są wykorzystywane w produkcji nawozów, leków, tworzyw sztucznych i wielu innych produktów.
Przykłady Zastosowań
- Chlorek sodu (NaCl): Przyprawa, konserwant, elektrolit, produkcja chloru i wodorotlenku sodu.
- Węglan sodu (Na2CO3): Produkcja szkła, papieru, mydeł i detergentów.
- Siarczan wapnia (CaSO4): Gips, materiał budowlany, dodatek do żywności.
- Azotan potasu (KNO3): Nawóz, składnik prochu strzelniczego, konserwant żywności.
- Fosforany: Nawozy, detergenty, dodatki do żywności.
Podsumowanie i Wskazówki do Kartkówki
Przygotowując się do kartkówki z wzorów i nazw soli, pamiętaj o kilku kluczowych kwestiach:
- Zrozum definicję soli i podział na różne typy.
- Naucz się rozpoznawać kationy i aniony.
- Opanuj zasady ustalania wartościowości.
- Ćwicz pisanie wzorów soli na podstawie nazw i odwrotnie.
- Zapamiętaj najważniejsze wyjątki i utrwalone nazwy.
- Rozwiązuj zadania praktyczne, aby utrwalić wiedzę.
Chemia soli może wydawać się skomplikowana, ale z odpowiednim przygotowaniem i regularnymi ćwiczeniami, możesz bez problemu opanować ten temat. Powodzenia na kartkówce! Pamiętaj, że systematyczna nauka i zrozumienie podstawowych zasad to klucz do sukcesu.