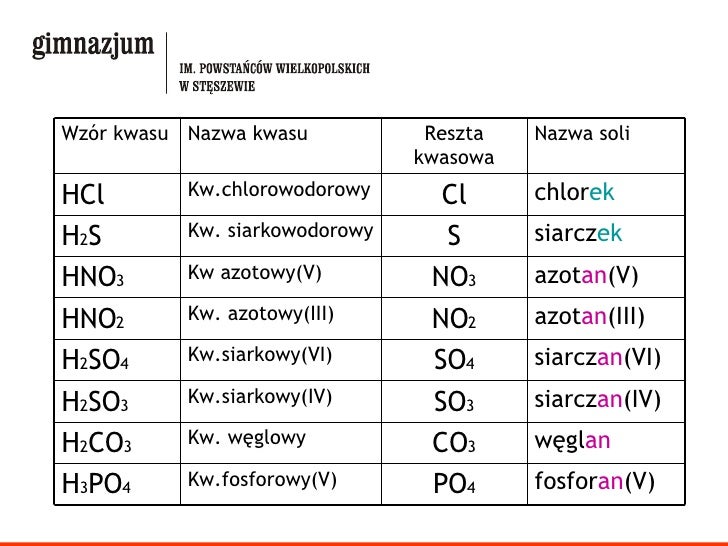
Wzory I Nazwy Soli Karta Pracy

Chemia to fascynująca dziedzina, która często wydaje się skomplikowana, zwłaszcza gdy zaczynamy mówić o wzorach i nazwach różnych związków. Ten artykuł ma na celu rozjaśnić zagadnienie soli – ich wzorów i nazw – w sposób przystępny i zrozumiały. Skierowany jest przede wszystkim do uczniów szkół podstawowych i średnich, którzy dopiero zaczynają swoją przygodę z chemią, a także dla wszystkich tych, którzy chcą odświeżyć swoją wiedzę na ten temat.
Wyobraź sobie, że jesteś detektywem, a sole to zagadkowe substancje, które musisz rozszyfrować! Każda sól ma swoją unikalną "tożsamość" – wzór i nazwę, które pozwalają nam ją zidentyfikować i zrozumieć jej właściwości. Gotów na wyzwanie?
Czym są sole? Podstawowe definicje
Zacznijmy od podstaw. Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Proces ten nazywamy reakcją zobojętniania. Najprościej mówiąc, kwas i zasada "neutralizują" się nawzajem, tworząc sól i wodę.
Przykładowo:
HCl (kwas solny) + NaOH (wodorotlenek sodu) → NaCl (chlorek sodu, czyli sól kuchenna) + H2O (woda)Jak widać, w reakcji kwasu solnego z wodorotlenkiem sodu powstaje dobrze znana nam sól kuchenna – chlorek sodu oraz woda.
Budowa soli
Sole składają się z kationu (jonu dodatniego) pochodzącego od zasady i anionu (jonu ujemnego) pochodzącego od kwasu. W przypadku chlorku sodu, kationem jest jon sodu (Na+), a anionem jon chlorkowy (Cl-).
Nomenklatura soli: Jak nazywamy sole?
Nazewnictwo soli opiera się na nazwie anionu i kationu, z uwzględnieniem wartościowości metali (kationów) i reszt kwasowych (anionów), zwłaszcza dla metali, które mogą przyjmować różne wartościowości.
Ogólna zasada nazewnictwa soli wygląda następująco:
* Nazwa anionu (pochodząca od reszty kwasowej) + nazwa kationu (nazwa metalu) + (wartościowość metalu, jeśli metal ma więcej niż jedną wartościowość w związkach)Na przykład:
* NaCl – chlorek sodu (sód ma tylko jedną wartościowość, więc nie podajemy jej w nazwie) * FeCl2 – chlorek żelaza(II) (żelazo występuje na II stopniu utlenienia) * FeCl3 – chlorek żelaza(III) (żelazo występuje na III stopniu utlenienia) * CuSO4 – siarczan(VI) miedzi(II) (miedź występuje na II stopniu utlenienia) * K2SO4 – siarczan(VI) potasu (potas ma tylko jedną wartościowość, więc nie podajemy jej w nazwie)Wzory soli: Jak je pisać?
Pisanie wzorów soli wymaga znajomości wartościowości kationów i anionów. Suma ładunków dodatnich i ujemnych w cząsteczce soli musi być równa zero. Innymi słowy, cząsteczka soli musi być elektrycznie obojętna.
Oto kilka kroków, które pomogą Ci pisać wzory soli:
1. Zidentyfikuj kation i anion. Na przykład, w chlorku magnezu kationem jest magnez (Mg2+), a anionem jest chlorek (Cl-). 2. Zapisz symbole pierwiastków, zaczynając od kationu, a następnie anionu. W naszym przykładzie: MgCl. 3. Określ wartościowość każdego jonu. Magnez ma wartościowość II (Mg2+), a chlorek ma wartościowość I (Cl-). 4. Skrzyżuj wartościowości. Wartościowość jednego jonu staje się indeksem stechiometrycznym drugiego jonu. W naszym przykładzie: Mg1Cl2 (indeksu 1 zazwyczaj się nie pisze). 5. Uprość wzór, jeśli to możliwe. W naszym przykładzie wzór pozostaje MgCl2.Przykłady pisania wzorów soli
* Węglan wapnia: Wapń (Ca2+), węglan (CO32-). Wzór: CaCO3. * Azotan(V) glinu: Glin (Al3+), azotan(V) (NO3-). Wzór: Al(NO3)3. (Zwróć uwagę na użycie nawiasów, ponieważ grupa azotanowa występuje trzykrotnie). * Fosforan(V) sodu: Sód (Na+), fosforan(V) (PO43-). Wzór: Na3PO4.Typy soli
Sole można podzielić na różne typy ze względu na ich pochodzenie, skład i właściwości.
- Sole obojętne: Powstają w wyniku reakcji mocnego kwasu z mocną zasadą. Przykład: NaCl.
- Sole kwaśne: Powstają, gdy kwas nie zostanie całkowicie zobojętniony. Zawierają wodorowy jon (H+). Przykład: NaHCO3 (wodorowęglan sodu).
- Sole zasadowe: Powstają, gdy zasada nie zostanie całkowicie zobojętniona. Zawierają jon hydroksylowy (OH-). Przykład: Cu(OH)Cl (chlorek hydroksomiedzi(II)).
- Sole podwójne: Zawierają dwa różne kationy. Przykład: KAl(SO4)2 (ałun potasowo-glinowy).
- Sole uwodnione (hydraty): Zawierają w swojej strukturze cząsteczki wody. Przykład: CuSO4·5H2O (siarczan(VI) miedzi(II) pentahydrat).
Karta Pracy: Przykładowe zadania
Aby utrwalić zdobytą wiedzę, proponuję rozwiązać kilka zadań:
- Napisz wzory następujących soli:
- Chlorek potasu
- Siarczan(VI) magnezu
- Azotan(V) wapnia
- Fosforan(V) żelaza(III)
- Podaj nazwy następujących soli:
- LiCl
- CaCO3
- Al2(SO4)3
- FeBr2
- Określ, czy dana sól jest obojętna, kwaśna czy zasadowa:
- Na2SO4
- KHSO4
- Mg(OH)Cl
Odpowiedzi:
- Wzory soli:
- Chlorek potasu: KCl
- Siarczan(VI) magnezu: MgSO4
- Azotan(V) wapnia: Ca(NO3)2
- Fosforan(V) żelaza(III): FePO4
- Nazwy soli:
- LiCl: chlorek litu
- CaCO3: węglan wapnia
- Al2(SO4)3: siarczan(VI) glinu
- FeBr2: bromek żelaza(II)
- Rodzaj soli:
- Na2SO4: obojętna
- KHSO4: kwaśna
- Mg(OH)Cl: zasadowa
Sole w życiu codziennym
Sole odgrywają niezwykle ważną rolę w naszym życiu. Używamy ich na co dzień, często nawet o tym nie wiedząc. Oto kilka przykładów:
- Sól kuchenna (NaCl): Do przyprawiania potraw i konserwowania żywności.
- Węglan sodu (Na2CO3): Używany w produkcji szkła, proszków do prania i zmiękczaczy wody.
- Wodorowęglan sodu (NaHCO3): Znany jako soda oczyszczona, używany w pieczeniu ciast, jako środek zobojętniający kwas żołądkowy i w gaśnicach.
- Siarczan wapnia (CaSO4): Składnik gipsu, używany w budownictwie i medycynie (opatrunki gipsowe).
- Azotan(V) potasu (KNO3): Składnik nawozów sztucznych, używany w produkcji prochu strzelniczego.
Podsumowanie
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć zagadnienie wzorów i nazw soli. Pamiętaj, że praktyka czyni mistrza! Im więcej będziesz ćwiczyć pisanie wzorów i nazywanie soli, tym łatwiej Ci to przyjdzie. Nie zrażaj się trudnościami – chemia może być naprawdę fascynująca!
Rozumienie nomenklatury soli to klucz do dalszej nauki chemii. Daje to solidną podstawę do zrozumienia reakcji chemicznych, właściwości związków i ich zastosowań. Pamiętaj, że wiedza o solach jest nie tylko przydatna na lekcjach chemii, ale również w życiu codziennym, pozwalając nam lepiej rozumieć otaczający nas świat.