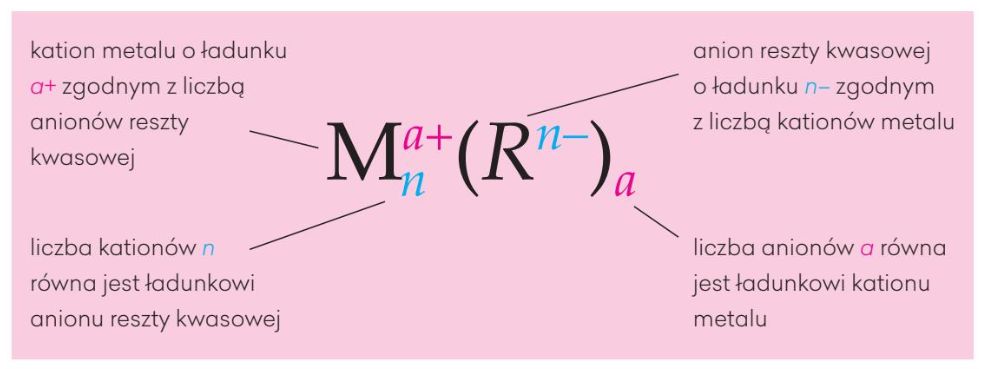Wzory I Nazwy Soli Gimnazjum
Czy kiedykolwiek zastanawiałeś się, co to tak naprawdę są sole i jak je nazwać? A może utknąłeś przy zadaniu domowym z chemii i nie wiesz, jak się za to zabrać? Wiem, że nauka o solach w gimnazjum może wydawać się trudna i skomplikowana. Te wszystkie wzory i nazwy mogą przyprawić o ból głowy! Ale nie martw się, jestem tutaj, żeby Ci pomóc.
Spróbujemy razem przejść przez ten temat krok po kroku, bez zbędnego chemicznego żargonu. Zobaczymy, że sole to wcale nie taka czarna magia, a ich nauka może być nawet całkiem... fajna!
Czym są sole?
Wyobraź sobie sól kuchenną, którą masz w domu. To jest tylko jeden z przykładów soli. Ale chemicznie rzecz biorąc, sole to związki, które powstają w wyniku reakcji kwasu z zasadą. Mówiąc prościej, to połączenie metalu (lub jonu amonowego) z reszta kwasową.
Sole charakteryzują się budową jonową. Oznacza to, że składają się z jonów dodatnich (kationów) i jonów ujemnych (anionów), które przyciągają się wzajemnie siłami elektrostatycznymi, tworząc sieć krystaliczną.
Przykład: Sól kuchenna (NaCl) to chlorek sodu. Składa się z jonów sodu (Na+) i jonów chlorkowych (Cl-).
Podział soli
Sole możemy podzielić na kilka kategorii, w zależności od ich składu i właściwości. Najczęściej spotykamy się z:
- Sole proste: Składają się z jednego rodzaju kationu i jednego rodzaju anionu (np. NaCl, KBr).
- Sole złożone: Zawierają więcej niż jeden rodzaj kationu lub anionu (np. wodorowęglany, wodorosole, hydroksosole, sole uwodnione).
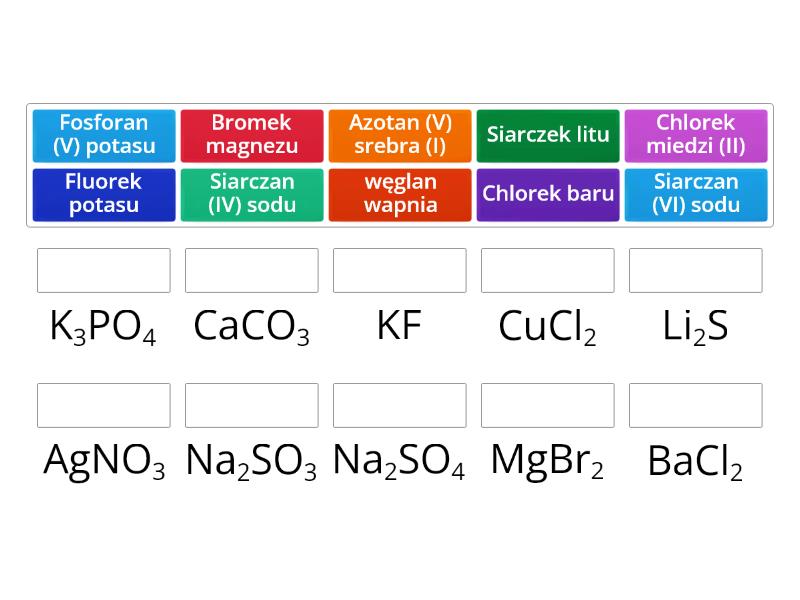
Sole proste - chlorki, siarczany, azotany...
Chlorki powstają z kwasu solnego (HCl). Mają wzór ogólny MeCln, gdzie Me to metal, a n to wartościowość metalu. Przykład: Chlorek sodu (NaCl), chlorek żelaza(III) (FeCl3).
Siarczany(VI) powstają z kwasu siarkowego(VI) (H2SO4). Mają wzór ogólny Mex(SO4)y, gdzie Me to metal, x i y to wartościowości metali i reszty kwasowej. Przykład: Siarczan(VI) miedzi(II) (CuSO4), siarczan(VI) potasu (K2SO4).
Azotany(V) powstają z kwasu azotowego(V) (HNO3). Mają wzór ogólny Me(NO3)n, gdzie Me to metal, a n to wartościowość metalu. Przykład: Azotan(V) srebra(I) (AgNO3), azotan(V) wapnia (Ca(NO3)2).
Sole złożone - wodorosole, hydroksosole...
Wodorosole zawierają w swojej cząsteczce atom wodoru (H+) pochodzący z kwasu. Powstają, gdy nie wszystkie atomy wodoru w kwasie zostaną zastąpione metalem. Przykład: Wodorowęglan sodu (NaHCO3), wodorosiarczan(VI) potasu (KHSO4).
Hydroksosole zawierają w swojej cząsteczce grupę hydroksylową (OH-). Powstają, gdy nie wszystkie jony OH- w wodorotlenku zostaną zastąpione resztą kwasową. Przykład: Chlorek dihydroksyglinu (Al(OH)2Cl).
Nazewnictwo soli
Nazwa soli składa się z dwóch części: nazwy anionu (reszty kwasowej) i nazwy kationu (metalu). Ważne jest określenie wartościowości metalu, zwłaszcza jeśli metal występuje na kilku stopniach utlenienia.
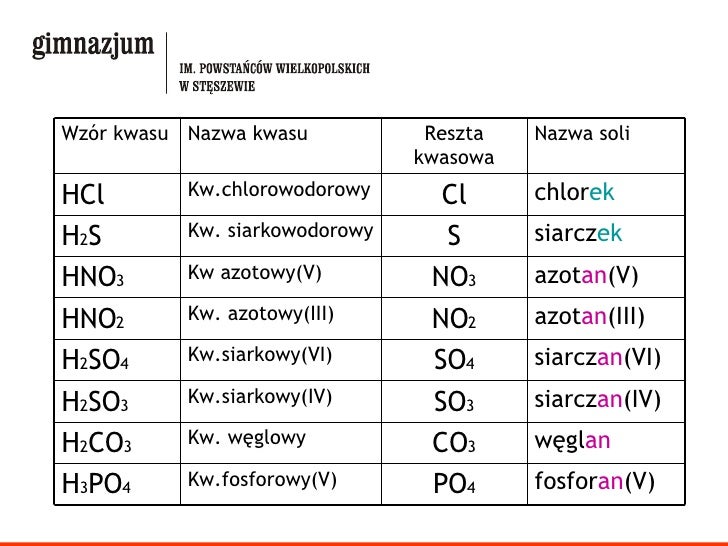
1. Nazwa reszty kwasowej (anionu):
- Dla kwasów beztlenowych (np. HCl) – nazwa pochodzi od nazwy niemetalu z końcówką -ek (np. chlorek, siarczek).
- Dla kwasów tlenowych (np. H2SO4) – nazwa pochodzi od nazwy niemetalu z końcówką zależną od wartościowości niemetalu w kwasie (np. siarczan(VI), azotan(V), fosforan(V)).
2. Nazwa metalu (kationu):
- Jeżeli metal ma tylko jedną wartościowość, podajemy po prostu jego nazwę (np. chlorek sodu).
- Jeżeli metal ma kilka wartościowości, podajemy jego nazwę i w nawiasie rzymską cyfrą oznaczamy jego wartościowość (np. chlorek żelaza(II), chlorek żelaza(III)).
Przykłady:
- NaCl - chlorek sodu (sód ma wartościowość I)
- FeCl2 - chlorek żelaza(II) (żelazo ma wartościowość II)
- FeCl3 - chlorek żelaza(III) (żelazo ma wartościowość III)
- CuSO4 - siarczan(VI) miedzi(II) (miedź ma wartościowość II)
- K2SO4 - siarczan(VI) potasu (potas ma wartościowość I)
Jak napisać wzór soli?
Pisanie wzorów soli wymaga uwzględnienia wartościowości jonów. Wartościowość kationu i anionu musi być "zrównoważona", tak aby suma ładunków w cząsteczce soli wynosiła zero.
Krok 1: Napisz symbol metalu i reszty kwasowej.
Krok 2: Określ wartościowość metalu i reszty kwasowej (możesz poszukać tych informacji w tablicy wartościowości).
Krok 3: Zapisz wartościowości "na krzyż". Oznacza to, że wartościowość metalu zapisujesz jako indeks przy reszcie kwasowej, a wartościowość reszty kwasowej zapisujesz jako indeks przy metalu.
Krok 4: Uprość indeksy, jeśli to możliwe. Jeśli indeksy są podzielne przez wspólną liczbę, podziel je przez nią.
Przykład: Napisz wzór siarczanu(VI) glinu.
- Glin (Al) ma wartościowość III.
- Reszta kwasowa siarczanowa(VI) (SO4) ma wartościowość II.
- Zapisujemy wartościowości "na krzyż": Al2(SO4)3
Ważne! Jeśli reszta kwasowa składa się z więcej niż jednego atomu, a jej indeks jest większy niż 1, to całą resztę kwasową bierzemy w nawias.
Praktyczne wskazówki
- Ucz się stopniowo: Nie próbuj od razu zapamiętać wszystkich wzorów i nazw. Zacznij od najprostszych soli i stopniowo przechodź do bardziej złożonych.
- Korzystaj z tablicy wartościowości: Tablica wartościowości to Twoja najlepsza przyjaciółka! Zawsze miej ją pod ręką podczas rozwiązywania zadań.
- Rób dużo przykładów: Im więcej zadań zrobisz, tym lepiej zrozumiesz zasady nazewnictwa i pisania wzorów soli.
- Nie bój się pytać: Jeśli czegoś nie rozumiesz, zapytaj nauczyciela, kolegę lub poszukaj informacji w internecie.
- Skup się na zrozumieniu: Ważne jest, aby zrozumieć, dlaczego sole mają takie nazwy i wzory, a nie tylko uczyć się ich na pamięć.
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć podstawy nazewnictwa i wzorów soli. Pamiętaj, że nauka wymaga czasu i cierpliwości. Nie zrażaj się trudnościami i kontynuuj naukę. Powodzenia!
Pamiętaj: Ćwiczenie czyni mistrza! Im więcej będziesz ćwiczył, tym lepiej zrozumiesz ten temat.