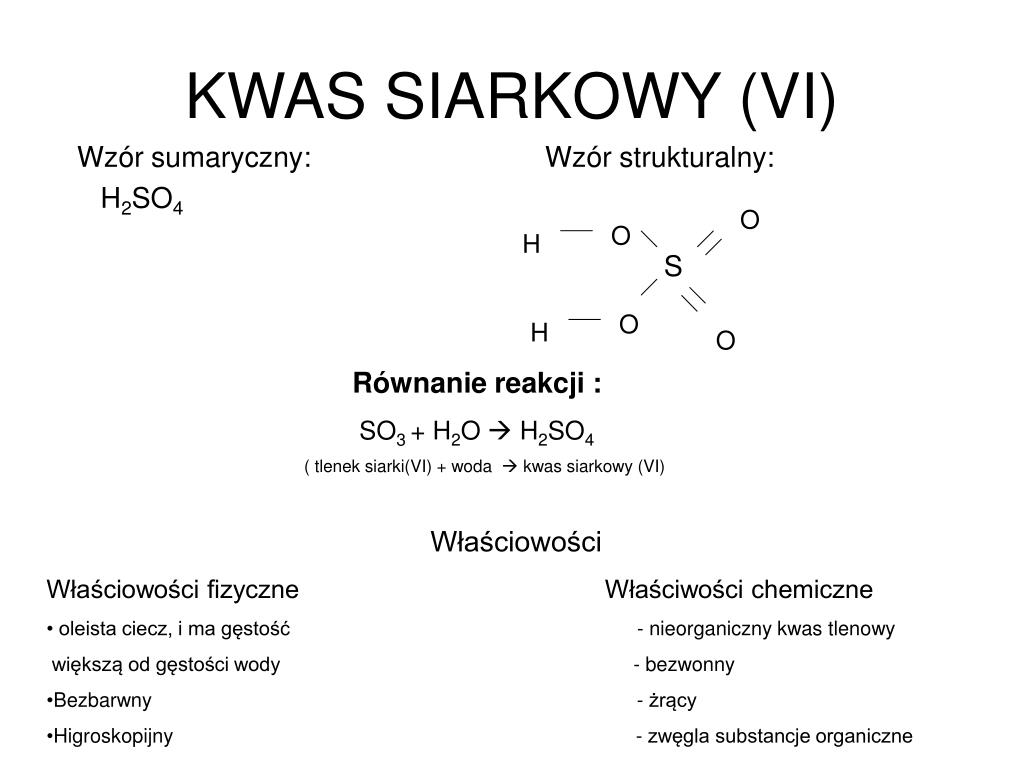
Wzór Sumaryczny Kwasu Węglowego
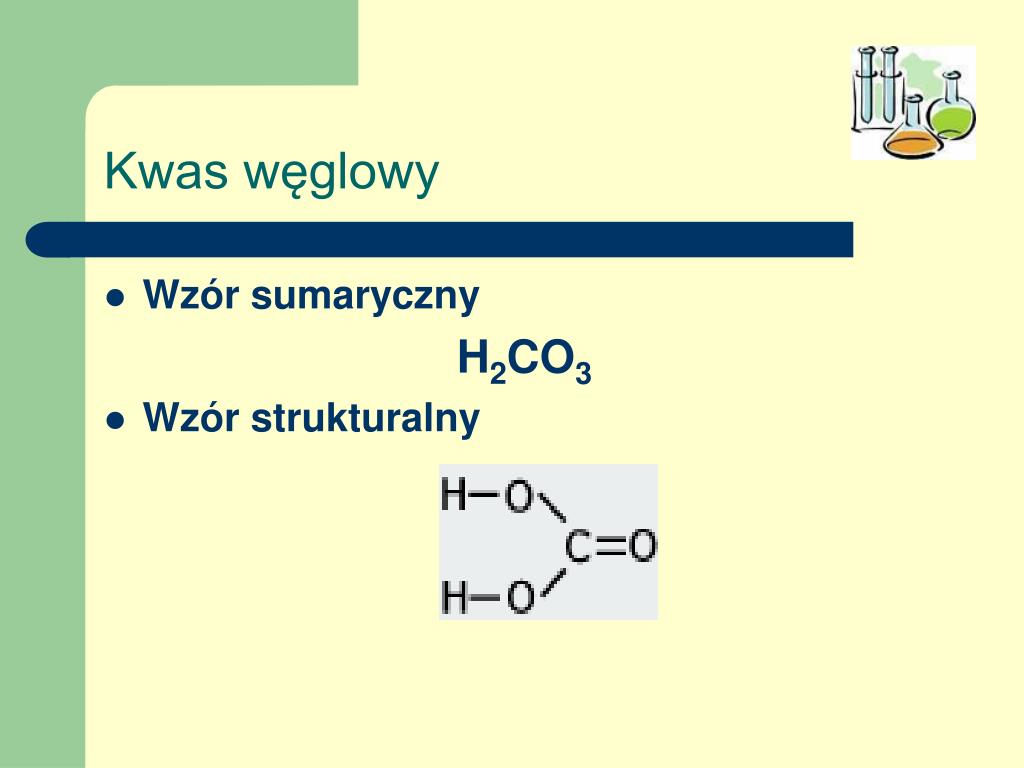
Kwas węglowy (H2CO3) to jeden z najpowszechniej występujących kwasów w przyrodzie, choć jego występowanie w czystej postaci jest ograniczone. Jest to słaby kwas, który powstaje w wyniku rozpuszczania dwutlenku węgla (CO2) w wodzie (H2O). Chociaż wzór sumaryczny jest prosty, to chemia kwasu węglowego jest dość skomplikowana i ma ogromne znaczenie dla wielu procesów biologicznych i geologicznych.
Powstawanie i Struktura Kwasu Węglowego
Kwas węglowy nie istnieje jako czysta substancja w normalnych warunkach. Powstaje on w wyniku odwracalnej reakcji pomiędzy dwutlenkiem węgla i wodą:
CO2(aq) + H2O(l) ⇌ H2CO3(aq)
Równowaga tej reakcji jest silnie przesunięta w lewo, co oznacza, że w roztworze wodnym przeważająca ilość dwutlenku węgla pozostaje w postaci rozpuszczonej (CO2(aq)), a tylko niewielka frakcja przekształca się w kwas węglowy (H2CO3). Struktura kwasu węglowego składa się z atomu węgla związanego z dwoma grupami hydroksylowymi (-OH) oraz atomem tlenu poprzez wiązanie podwójne (C=O).
Dlaczego Kwas Węglowy Jest Słaby?
Kwas węglowy jest klasyfikowany jako słaby kwas ze względu na jego niską zdolność do dysocjacji w roztworze wodnym. Oznacza to, że tylko niewielka część cząsteczek H2CO3 rozpada się na jony wodorowe (H+) i jony wodorowęglanowe (HCO3-):
H2CO3(aq) ⇌ H+(aq) + HCO3-(aq)
Następnie, jon wodorowęglanowy może ulegać dalszej dysocjacji, tworząc jon węglanowy (CO32-):
HCO3-(aq) ⇌ H+(aq) + CO32-(aq)
Stałe dysocjacji (Ka1 i Ka2) dla tych reakcji są bardzo niskie, co potwierdza słabą kwasowość H2CO3. Niska stabilność kwasu węglowego w roztworze wodnym także przyczynia się do jego słabej kwasowości.
Znaczenie Kwasu Węglowego
Pomimo swojej słabości i niskiej stabilności, kwas węglowy odgrywa kluczową rolę w wielu istotnych procesach:
Regulacja pH Krwi
Układ buforowy węglanowy jest niezwykle ważny dla utrzymania stałego pH krwi u ludzi i innych zwierząt. Składa się on z kwasu węglowego (H2CO3), jonu wodorowęglanowego (HCO3-) oraz jonu węglanowego (CO32-). Ten układ buforowy działa poprzez neutralizowanie zarówno nadmiaru kwasów, jak i zasad we krwi. Kiedy pH krwi spada (staje się bardziej kwaśne), jon wodorowęglanowy reaguje z nadmiarem jonów wodorowych, tworząc kwas węglowy, który następnie rozkłada się na wodę i dwutlenek węgla, wydalany przez płuca. Odwrotnie, gdy pH krwi wzrasta (staje się bardziej zasadowe), kwas węglowy dysocjuje, uwalniając jony wodorowe i obniżając pH. Zaburzenia w tym systemie mogą prowadzić do poważnych stanów, takich jak kwasica lub zasadowica.
Wietrzenie Skał Wapiennych
Kwas węglowy odgrywa istotną rolę w procesie wietrzenia chemicznego skał wapiennych (głównie węglanu wapnia - CaCO3). Kiedy deszcz, który zawiera rozpuszczony dwutlenek węgla, styka się ze skałami wapiennymi, powstaje kwas węglowy. Ten kwas reaguje z węglanem wapnia, przekształcając go w wodorowęglan wapnia (Ca(HCO3)2), który jest rozpuszczalny w wodzie. Proces ten prowadzi do rozpuszczania skał wapiennych i tworzenia charakterystycznych form krasowych, takich jak jaskinie, stalaktyty i stalagmity.
CaCO3(s) + H2CO3(aq) ⇌ Ca2+(aq) + 2HCO3-(aq)
Oceanografia
Kwas węglowy jest także ważnym składnikiem cyklu węglowego w oceanach. Oceany absorbują znaczną ilość dwutlenku węgla z atmosfery. Po rozpuszczeniu w wodzie, CO2 przekształca się w kwas węglowy, który następnie dysocjuje na jony wodorowęglanowe i węglanowe. Te jony mają wpływ na pH wody morskiej i są wykorzystywane przez organizmy morskie, takie jak koralowce i skorupiaki, do budowy swoich szkieletów i muszli. Zwiększone stężenie dwutlenku węgla w atmosferze prowadzi do zakwaszenia oceanów, co ma negatywny wpływ na ekosystemy morskie.
Produkcja Napojów Gazowanych
Kwas węglowy jest wykorzystywany w produkcji napojów gazowanych. Dwutlenek węgla jest rozpuszczany w wodzie pod ciśnieniem, tworząc kwas węglowy, który odpowiada za charakterystyczny "musujący" efekt. Po otwarciu napoju, ciśnienie spada, a kwas węglowy rozkłada się na wodę i dwutlenek węgla, który uwalnia się w postaci bąbelków.
Real-World Examples and Data
Przykład 1: Oceaniczne zakwaszenie. Monitorowanie pH wód oceanicznych na przestrzeni ostatnich dziesięcioleci wykazuje spadek pH, co jest bezpośrednio związane ze wzrostem stężenia CO2 w atmosferze. Badania prowadzone przez NOAA (National Oceanic and Atmospheric Administration) wskazują, że od początku ery industrialnej średnie pH oceanów spadło o około 0.1 jednostki. Choć wydaje się to niewielka zmiana, ma ona poważne konsekwencje dla organizmów morskich, szczególnie tych, które budują struktury z węglanu wapnia.
Przykład 2: Regulacja pH krwi. Pomiar stężenia wodorowęglanów (HCO3-) we krwi jest rutynowym badaniem laboratoryjnym, które pomaga w diagnozowaniu zaburzeń równowagi kwasowo-zasadowej. Prawidłowy zakres stężenia wodorowęglanów we krwi wynosi zazwyczaj 22-29 mmol/L. Odchylenia od tego zakresu mogą wskazywać na problemy z funkcjonowaniem nerek, płuc lub innych narządów odpowiedzialnych za utrzymanie homeostazy kwasowo-zasadowej.
Przykład 3: Jaskinie. Jaskinie, takie jak Jaskinia Niedźwiedzia w Kletnie, są doskonałym przykładem działania kwasu węglowego na skały wapienne. Woda przesiąkająca przez skały, zawierająca rozpuszczony dwutlenek węgla, powoli rozpuszcza węglan wapnia, tworząc rozległe systemy korytarzy i komór. Proces ten trwa miliony lat i prowadzi do powstania unikalnych formacji skalnych.
Podsumowanie
Mimo prostej formuły (H2CO3), kwas węglowy odgrywa niezwykle ważną rolę w wielu procesach naturalnych i przemysłowych. Od regulacji pH krwi po wietrzenie skał i zakwaszenie oceanów, jego obecność ma ogromny wpływ na środowisko i życie na Ziemi. Zrozumienie chemii kwasu węglowego jest kluczowe dla zrozumienia tych procesów i radzenia sobie z problemami, takimi jak zmiany klimatyczne i ochrona ekosystemów morskich.
Wezwanie do działania: Dbajmy o środowisko, redukując emisję dwutlenku węgla do atmosfery. Nasze działania mają bezpośredni wpływ na kwasowość oceanów i zdrowie naszej planety. Edukujmy się i innych na temat znaczenia kwasu węglowego i jego wpływu na środowisko.

+Wzór+sumaryczny+Wzór+strukturalny.jpg)