Wzór Sumaryczny Kwasu Siarkowego 4
+Wzór+sumaryczny+Wzór+strukturalny.jpg)
Czy kiedykolwiek zastanawiałeś się nad tajemniczą mocą substancji, która potrafi trawić metale, a jednocześnie jest niezbędna w produkcji nawozów i detergentów? Mowa o kwasie siarkowym – substancji tak wszechstronnej, że bez niej trudno wyobrazić sobie współczesny przemysł. Chociaż jego nazwa może brzmieć groźnie, zrozumienie jego właściwości i budowy chemicznej jest kluczowe dla każdego, kto interesuje się chemią, od licealisty po studenta, a nawet osoby zawodowo związane z przemysłem chemicznym.
Celem tego artykułu jest dogłębne wyjaśnienie wzoru sumarycznego kwasu siarkowego(VI), czyli H2SO4. Skupimy się na zrozumieniu, co ten wzór oznacza, jakie informacje o związku chemicznym przekazuje oraz jak odnosi się do właściwości i zastosowań kwasu siarkowego. Staramy się to zrobić w sposób przystępny i zrozumiały, unikając nadmiernego żargonu chemicznego.
Czym jest Wzór Sumaryczny?
Zacznijmy od podstaw. Wzór sumaryczny, zwany także empirycznym, to skrócony zapis, który informuje nas o rodzaju i liczbie atomów poszczególnych pierwiastków wchodzących w skład danego związku chemicznego. Jest to najprostszy sposób na przedstawienie składu chemicznego substancji. Nie ujawnia on jednak, jak te atomy są połączone ze sobą, ani o strukturze przestrzennej cząsteczki.
Dla przykładu, wzór sumaryczny wody to H2O. Oznacza to, że jedna cząsteczka wody składa się z dwóch atomów wodoru (H) i jednego atomu tlenu (O). Podobnie, wzór sumaryczny dwutlenku węgla to CO2, co oznacza jeden atom węgla (C) i dwa atomy tlenu (O).
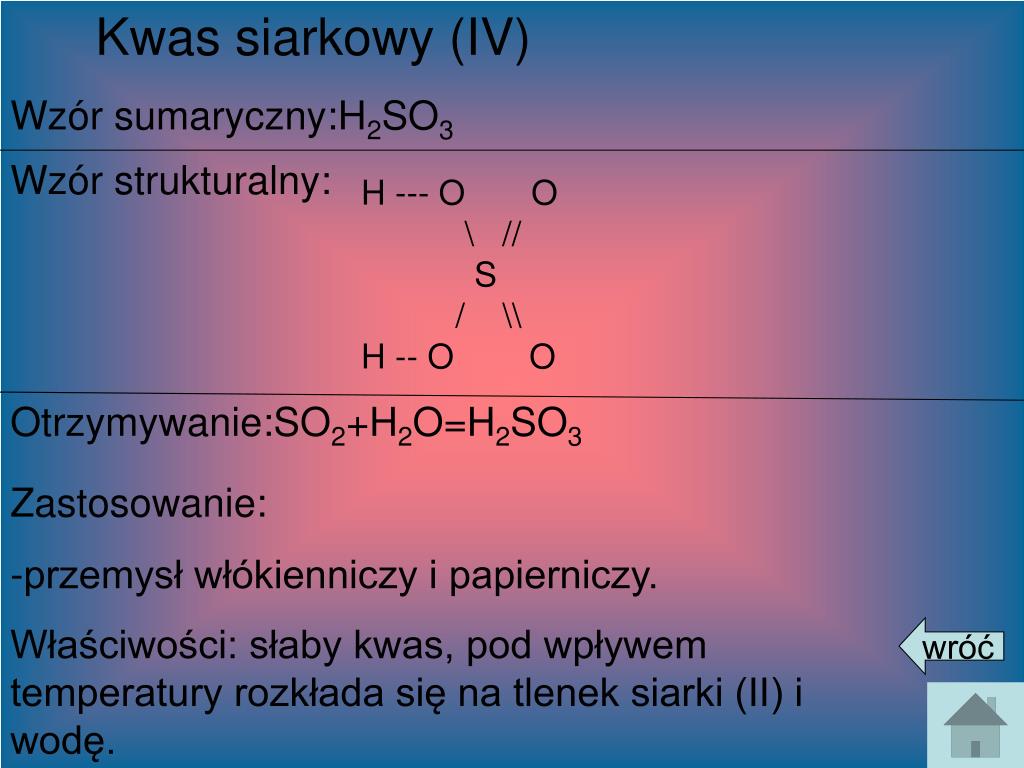
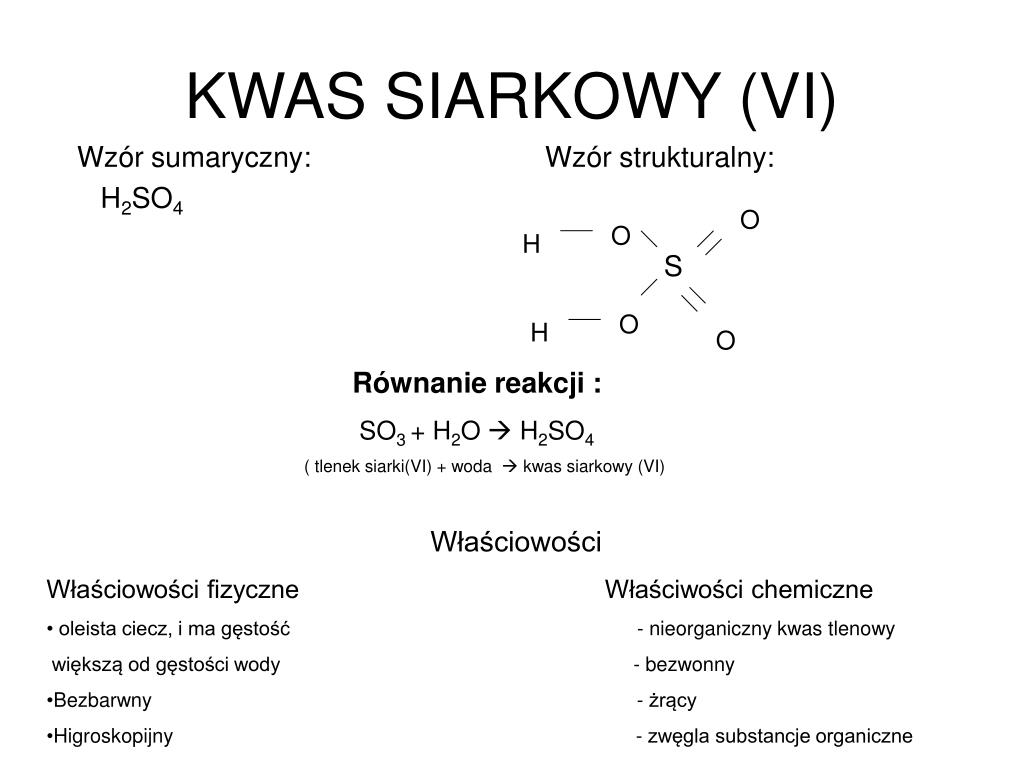
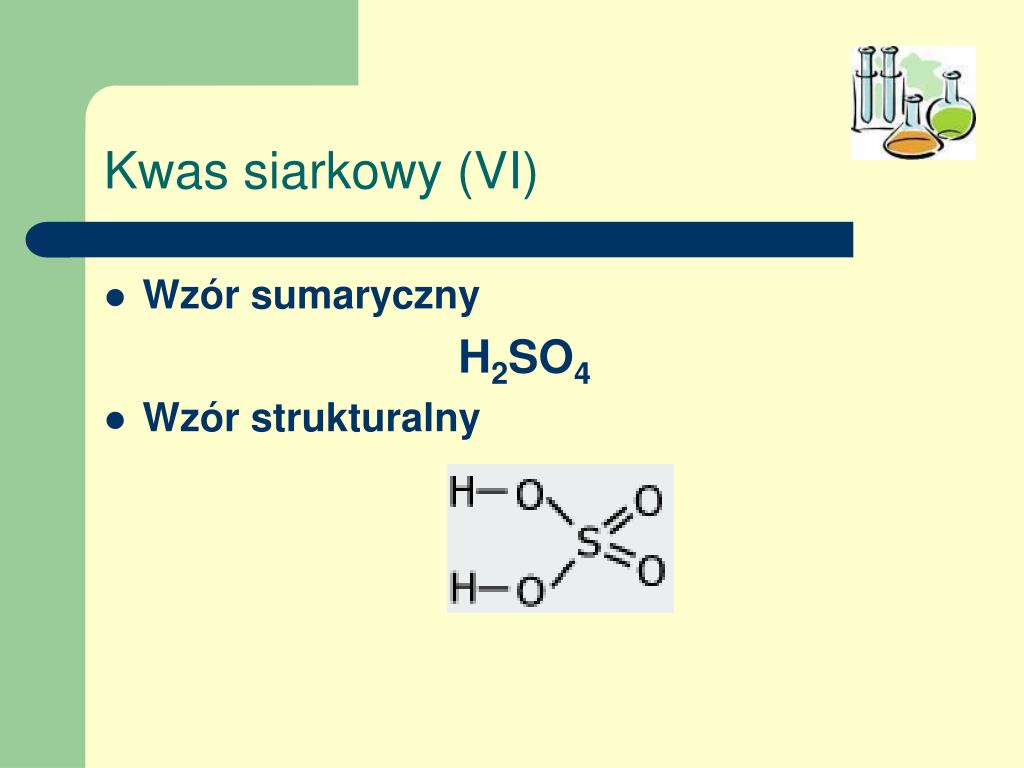
Wzór Sumaryczny Kwasu Siarkowego(VI): H2SO4
Wzór sumaryczny kwasu siarkowego(VI) to H2SO4. Spróbujmy go rozłożyć na czynniki pierwsze:
- H: Symbol chemiczny wodoru. Wzór mówi nam, że w jednej cząsteczce kwasu siarkowego znajdują się dwa atomy wodoru.
- S: Symbol chemiczny siarki. Wzór informuje nas, że w jednej cząsteczce kwasu siarkowego znajduje się jeden atom siarki.
- O: Symbol chemiczny tlenu. Wzór mówi nam, że w jednej cząsteczce kwasu siarkowego znajdują się cztery atomy tlenu.
Zatem, H2SO4 jednoznacznie wskazuje, że każda cząsteczka kwasu siarkowego(VI) składa się z dwóch atomów wodoru, jednego atomu siarki i czterech atomów tlenu.
Dlaczego (VI)?
W nazwie kwasu siarkowego występuje rzymska cyfra (VI). Oznacza ona stopień utlenienia siarki w tym związku. Stopień utlenienia to formalna wartość ładunku elektrycznego, jaki przypisalibyśmy atomowi w związku chemicznym, zakładając, że wszystkie wiązania są jonowe. W przypadku kwasu siarkowego(VI), siarka ma stopień utlenienia +6.
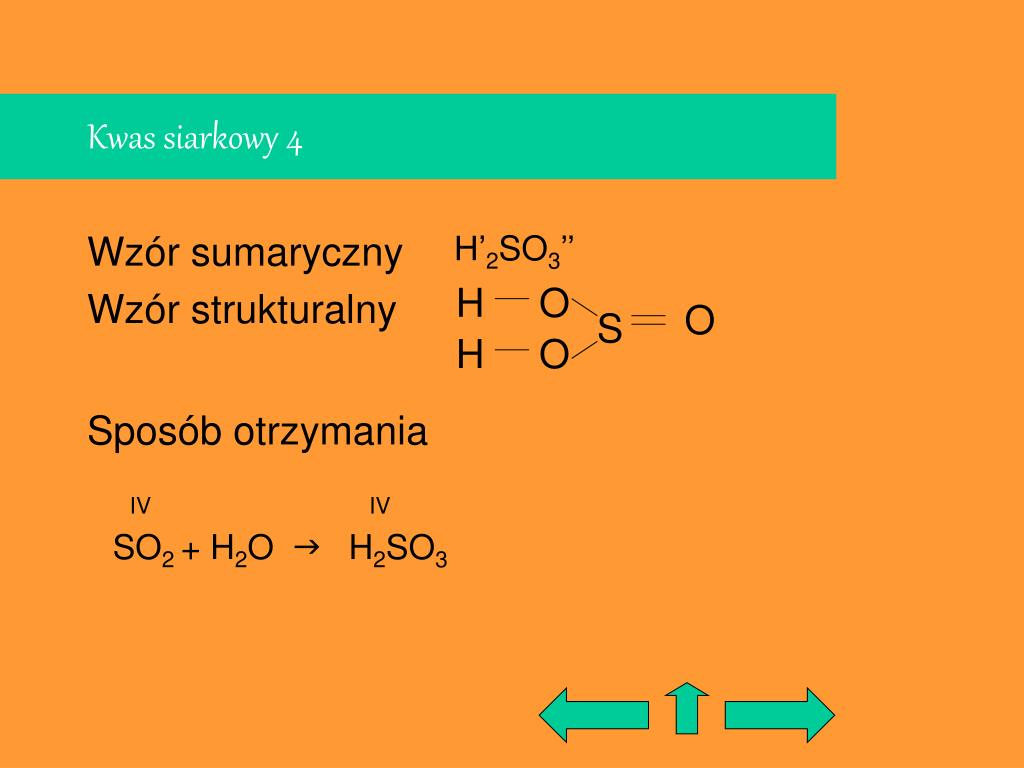
Istnieją inne kwasy siarki, w których siarka ma inny stopień utlenienia, na przykład kwas siarkawy (H2SO3), gdzie siarka ma stopień utlenienia +4. Dlatego ważne jest precyzowanie, o który kwas siarki chodzi, poprzez podanie stopnia utlenienia.
Właściwości Kwasu Siarkowego Wynikające ze Wzoru Sumarycznego
Chociaż wzór sumaryczny nie ujawnia struktury cząsteczki, możemy na jego podstawie wywnioskować pewne właściwości kwasu siarkowego:
- Kwasowość: Obecność dwóch atomów wodoru (H2) sugeruje, że kwas siarkowy jest kwasem dwuprotonowym. Oznacza to, że w roztworze wodnym może oddawać dwa protony (jony wodorowe, H+). Oddawanie protonów jest cechą charakterystyczną kwasów.
- Higroskopijność: Kwas siarkowy ma bardzo silne właściwości higroskopijne, czyli zdolność do pochłaniania wody z otoczenia. Wynika to z polarności wiązań w cząsteczce H2SO4, które silnie oddziałują z polarnymi cząsteczkami wody.
- Silny utleniacz: Ze względu na wysoką elektroujemność tlenu (O) i wysoki stopień utlenienia siarki (+6), kwas siarkowy jest silnym utleniaczem. Oznacza to, że ma zdolność do przyjmowania elektronów od innych substancji, powodując ich utlenianie.
Zastosowania Kwasu Siarkowego
Kwas siarkowy jest jednym z najważniejszych związków chemicznych w przemyśle. Jego zastosowania są niezwykle szerokie:
- Produkcja nawozów: Znaczna część produkowanego kwasu siarkowego jest wykorzystywana do wytwarzania nawozów fosforowych, takich jak superfosfat.
- Przemysł chemiczny: Kwas siarkowy jest wykorzystywany jako katalizator w wielu reakcjach chemicznych, np. w produkcji tworzyw sztucznych, barwników, leków i detergentów.
- Przemysł metalurgiczny: Stosowany do trawienia i oczyszczania metali przed dalszą obróbką.
- Przemysł petrochemiczny: Wykorzystywany w procesach rafinacji ropy naftowej.
- Akumulatory ołowiowe: Kwas siarkowy stanowi elektrolit w akumulatorach samochodowych.
Przykład z Życia Codziennego: Akumulator Samochodowy
Pomyśl o akumulatorze w Twoim samochodzie. Bez niego nie uruchomisz silnika. Elektrolitem w akumulatorze ołowiowym jest właśnie roztwór kwasu siarkowego. Reakcje chemiczne zachodzące w akumulatorze, w których uczestniczy kwas siarkowy, umożliwiają generowanie prądu elektrycznego potrzebnego do rozruchu silnika.
Bezpieczeństwo Pracy z Kwasem Siarkowym
Ze względu na swoje silne właściwości korozyjne, praca z kwasem siarkowym wymaga zachowania szczególnej ostrożności:
- Ochrona osobista: Należy zawsze używać okularów ochronnych, rękawic kwasoodpornych i fartucha.
- Rozcieńczanie: Kwas siarkowy zawsze dodaje się do wody, a nie odwrotnie. Dodawanie wody do stężonego kwasu może spowodować gwałtowne wrzenie i rozpryskiwanie kwasu.
- Wentylacja: Pracę należy prowadzić w dobrze wentylowanym pomieszczeniu.
- Neutralizacja: W przypadku rozlania kwasu, należy go zneutralizować zasadą (np. roztworem wodorowęglanu sodu).
Podsumowanie
Wzór sumaryczny kwasu siarkowego(VI), H2SO4, informuje nas o rodzaju i liczbie atomów wchodzących w skład cząsteczki: dwa atomy wodoru, jeden atom siarki i cztery atomy tlenu. Chociaż nie ujawnia struktury cząsteczki, pozwala na wywnioskowanie wielu ważnych właściwości kwasu siarkowego, takich jak kwasowość, higroskopijność i silne właściwości utleniające.
Zrozumienie wzoru sumarycznego i jego implikacji jest kluczowe dla osób studiujących chemię, pracujących w przemyśle chemicznym oraz dla każdego, kto chce poszerzyć swoją wiedzę na temat substancji chemicznych, które otaczają nas w życiu codziennym.
Pamiętajmy, że chemia to nie tylko skomplikowane wzory i reakcje, ale przede wszystkim zrozumienie świata, w którym żyjemy. Wiedza o kwasie siarkowym, jednym z najważniejszych związków chemicznych, z pewnością pomoże Ci lepiej zrozumieć procesy zachodzące w przemyśle, w przyrodzie, a nawet w Twoim samochodzie!