Wzór Strukturalny Kwasu Siarkowego Iv
+Wzór+sumaryczny+Wzór+strukturalny.jpg)
Drodzy Nauczyciele, dzisiejszy artykuł poświęcony jest wzorowi strukturalnemu kwasu siarkowego(IV), czyli kwasu siarkawego (H2SO3). Jest to temat, który choć z pozoru prosty, może nastręczać uczniom pewne trudności. Poniżej znajdziecie praktyczne wskazówki, jak w przystępny sposób omówić ten związek na lekcji, jakie są typowe błędy popełniane przez uczniów i jak uatrakcyjnić naukę o nim.
Wprowadzenie teoretyczne
Kwas siarkowy(IV), znany również jako kwas siarkawy, to słaby kwas nieorganiczny. Nie występuje w postaci czystej, ale powstaje w wyniku rozpuszczania dwutlenku siarki (SO2) w wodzie. Proces ten jest odwracalny, co oznacza, że SO2 i H2O reagują ze sobą, tworząc H2SO3, który następnie może się rozłożyć z powrotem na SO2 i H2O. Kwas ten jest ważny w różnych procesach chemicznych, np. jako reduktor oraz w przemyśle spożywczym jako konserwant (E220). Ważne jest, by uświadomić uczniom, że termin "kwas siarkawy" odnosi się do wodnego roztworu SO2, a nie do konkretnej, wyizolowanej substancji.
Struktura kwasu siarkowego(IV)
Kluczowym elementem w zrozumieniu właściwości kwasu siarkawego jest jego wzór strukturalny. Istnieją dwie główne formy rezonansowe H2SO3: jedna z atomem siarki związanym z dwoma grupami hydroksylowymi (-OH) i jednym atomem tlenu podwójnym wiązaniem (S=O), oraz druga, mniej stabilna, z atomem wodoru związanym bezpośrednio z siarką (S-H) oraz atomem tlenu związanym pojedynczym wiązaniem z siarką i atomem wodoru (S-OH). Dominującą formą jest jednak ta pierwsza: H-O-S(=O)-O-H.
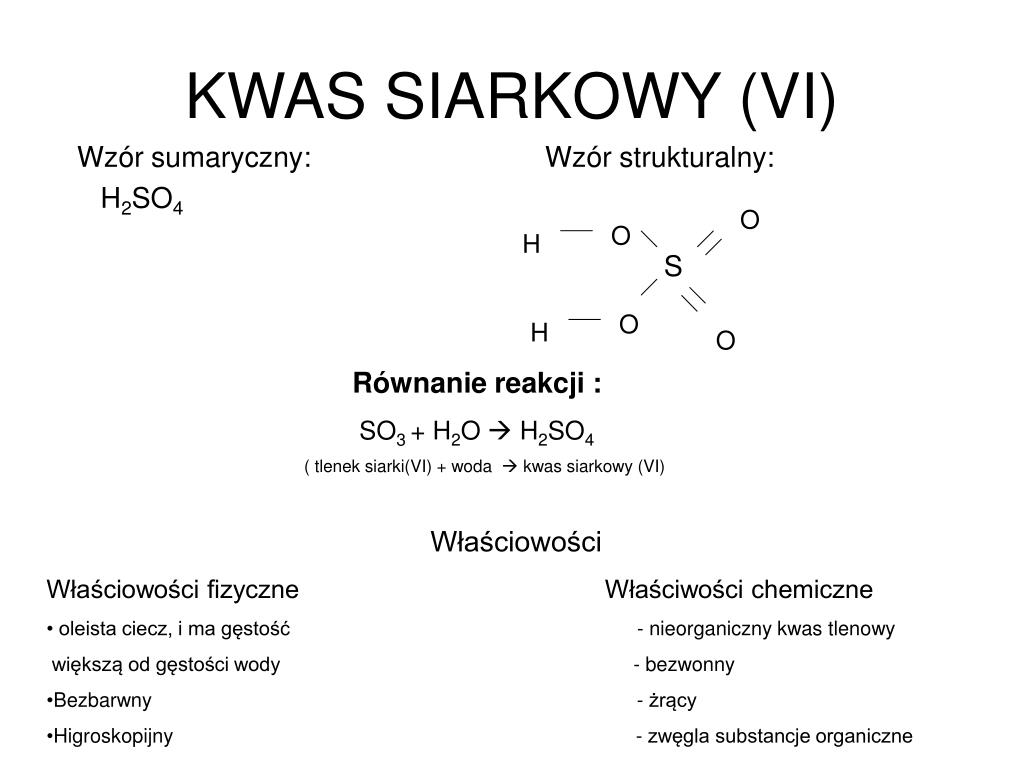
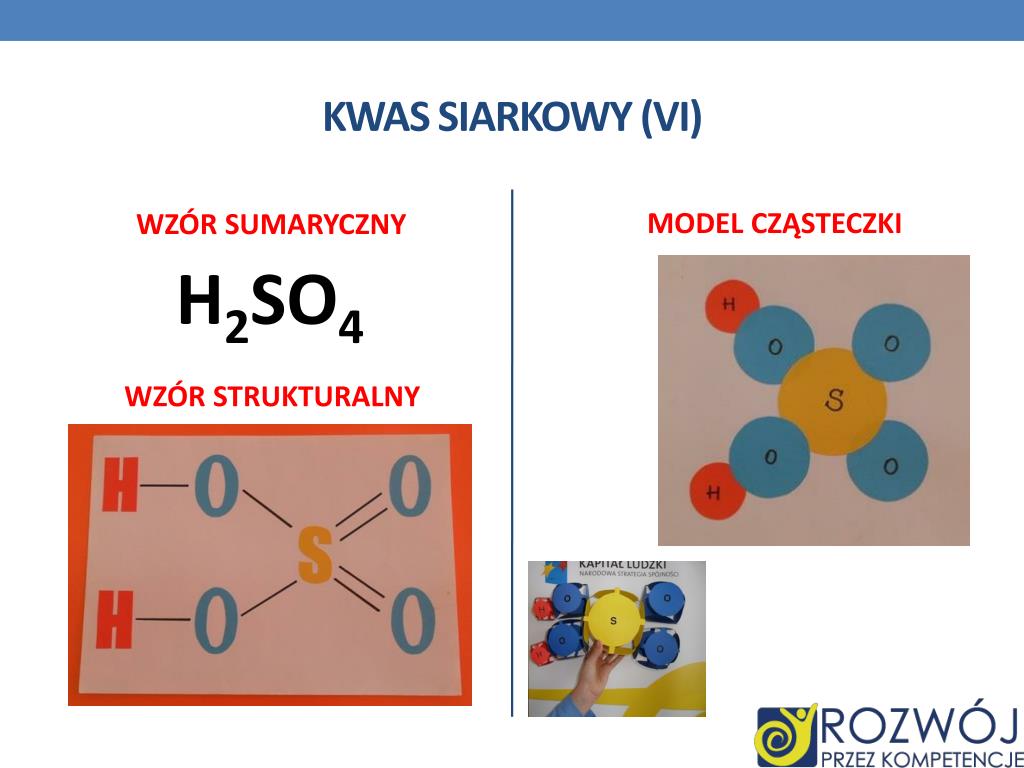
Warto podkreślić, że struktura ta nie jest identyczna ze strukturą kwasu siarkowego(VI) (H2SO4), gdzie siarka połączona jest z dwoma grupami hydroksylowymi i dwoma atomami tlenu za pomocą wiązań podwójnych. Różnica ta wynika z różnej wartościowości siarki – w kwasie siarkawym siarka jest czterowartościowa, a w siarkowym – sześciowartościowa.
Jak tłumaczyć wzór strukturalny w klasie?
- Zacznij od podstaw: Przypomnij uczniom pojęcie wartościowości pierwiastków i zasady tworzenia wzorów strukturalnych. Upewnij się, że rozumieją, jak reprezentować wiązania pojedyncze, podwójne i wolne pary elektronowe.
- Wykorzystaj modele: Modele przestrzenne atomów i wiązań są niezwykle pomocne w wizualizacji struktury kwasu siarkawego. Uczniowie mogą samodzielnie zbudować model, co znacząco poprawi ich zrozumienie. Dostępne są również modele wirtualne, które można wyświetlić na tablicy interaktywnej.
- Rysuj krok po kroku: Demonstruj na tablicy proces rysowania wzoru strukturalnego. Zacznij od atomu centralnego (siarki), następnie dodawaj atomy tlenu i wodoru, pamiętając o odpowiedniej wartościowości każdego pierwiastka. Wyjaśnij, dlaczego siarka tworzy podwójne wiązanie z jednym atomem tlenu.
- Porównaj z kwasem siarkowym(VI): Zestawienie wzorów strukturalnych kwasu siarkawego i siarkowego pomoże uczniom zrozumieć różnice w ich budowie i właściwościach. Podkreśl, że różnica w wartościowości siarki prowadzi do odmiennej liczby atomów tlenu związanych z atomem centralnym.
- Wykorzystaj analogie: Można porównać strukturę kwasu siarkawego do "niekompletnej" wersji kwasu siarkowego, brakującej jednego atomu tlenu.
Typowe błędy i jak im zapobiegać
Uczniowie często popełniają następujące błędy:
- Błędne rysowanie wzoru strukturalnego: Zdarza się, że uczniowie rysują wzory z nieprawidłową liczbą wiązań przy atomie siarki lub tlenu. Rozwiązanie: Powtórz zasady wartościowości i dokładnie sprawdzaj rysunki uczniów.
- Mylenie kwasu siarkawego z siarkowym: Uczniowie mylą te dwa kwasy ze względu na podobieństwo nazw. Rozwiązanie: Wyraźnie podkreśl różnicę w wartościowości siarki i liczbie atomów tlenu w obu kwasach. Stosuj nazewnictwo systematyczne (kwas siarkowy(IV) i kwas siarkowy(VI)).
- Nie rozumienie rezonansu: Uczniowie mogą mieć problem z pojęciem rezonansu i istnieniem różnych form rezonansowych kwasu siarkawego. Rozwiązanie: Wyjaśnij koncepcję rezonansu jako delokalizacji elektronów i przedstaw obie formy rezonansowe kwasu siarkawego, podkreślając, która z nich jest bardziej stabilna.
- Uważanie, że kwas siarkawy występuje w czystej postaci: Rozwiązanie: Podkreśl, że mówimy o roztworze SO2 w wodzie.
Jak uatrakcyjnić lekcję?
Oto kilka propozycji, jak uczynić lekcję o kwasie siarkawym bardziej angażującą:
- Doświadczenie: Przeprowadź doświadczenie, w którym uczniowie będą mogli zaobserwować powstawanie kwasu siarkawego poprzez rozpuszczanie SO2 w wodzie. Można to zrobić, spalając siarkę w probówce, a następnie wprowadzając powstały SO2 do wody z dodatkiem wskaźnika (np. oranżu metylowego), który zmieni kolor pod wpływem kwasu. Pamiętaj o zachowaniu środków ostrożności i odpowiedniej wentylacji.
- Quiz interaktywny: Wykorzystaj platformy internetowe do tworzenia quizów, w których uczniowie będą mogli sprawdzać swoją wiedzę na temat wzoru strukturalnego, właściwości i zastosowań kwasu siarkawego.
- Burza mózgów: Poproś uczniów o wymyślenie zastosowań kwasu siarkawego w przemyśle i życiu codziennym. Zwróć uwagę na jego właściwości redukujące i konserwujące.
- Gra dydaktyczna: Stwórz grę, w której uczniowie będą musieli dopasowywać wzory strukturalne do nazw związków, lub rozwiązywać zadania związane z reakcjami, w których uczestniczy kwas siarkawy.
- Dyskusja: Zorganizuj dyskusję na temat wpływu emisji SO2 na środowisko i powstawania kwaśnych deszczy. W ten sposób uczniowie zobaczą, że chemia ma realny wpływ na ich życie.
Pamiętaj, że kluczem do sukcesu jest jasne i przystępne tłumaczenie, wizualizacja i angażowanie uczniów w proces uczenia się. Dzięki temu, nawet pozornie trudny temat, jakim jest wzór strukturalny kwasu siarkowego(IV), stanie się zrozumiały i interesujący.
Mamy nadzieję, że ten artykuł okazał się pomocny. Życzymy owocnych lekcji!



+Otrzymywanie:+SO3+%2B+H2O+H2SO4.jpg)