Wszystkie Wzory I Nazwy Soli
Rozumienie chemii, a w szczególności soli, bywa dla wielu z nas trudnym zadaniem. Mnogość wzorów, skomplikowane nazewnictwo i abstrakcyjne koncepty potrafią zniechęcić. Nie jesteś sam! Wiele osób boryka się z podobnymi problemami. Celem tego artykułu jest jednak, aby przybliżyć Ci świat soli w sposób przystępny i zrozumiały, skupiając się na praktycznym zastosowaniu tej wiedzy i pomijając zbędny żargon.
Sól - Czym Tak Naprawdę Jest?
Sól to w chemii związek jonowy powstały w wyniku reakcji kwasu z zasadą. Brzmi skomplikowanie? Spójrzmy na to prościej. Wyobraź sobie, że masz dwa magnesy – jeden oznaczony jako „kwas”, a drugi jako „zasada”. Kiedy te magnesy się zetkną, powstaje coś nowego – „sól” – a dodatkowo uwalnia się woda.
W praktyce: Sól kuchenna (NaCl) to wynik reakcji kwasu solnego (HCl) z wodorotlenkiem sodu (NaOH). Widzisz? Już brzmi mniej strasznie!
Ale soli jest całe mnóstwo! Różnią się one właściwościami i zastosowaniem. I tu pojawia się wyzwanie – jak się w tym wszystkim połapać?
Dlaczego Warto Znać Wzory i Nazwy Soli?
Możesz pomyśleć: "Po co mi to w życiu?". Otóż, znajomość soli jest przydatna w wielu dziedzinach:
- Gotowanie: Sól kuchenna to podstawa, ale soda oczyszczona (wodorowęglan sodu) czy proszek do pieczenia (mieszanka różnych soli) też są solami i wpływają na smak i strukturę potraw.
- Sprzątanie: Węglan sodu (soda kalcynowana) jest skutecznym środkiem czyszczącym.
- Rolnictwo: Nawozy mineralne, np. azotan amonu, to sole, które dostarczają roślinom niezbędnych składników odżywczych.
- Medycyna: Wiele leków zawiera sole, np. chlorek potasu, który reguluje pracę serca.
- Przemysł: Sole wykorzystywane są w produkcji tworzyw sztucznych, barwników, a nawet w procesach galwanizacji.
Widzisz, jak bardzo sole wpływają na nasze codzienne życie? Rozumiejąc ich wzory i nazwy, możesz podejmować bardziej świadome decyzje konsumenckie, lepiej rozumieć skład produktów i po prostu być bardziej świadomym obywatelem.
Jak Rozpoznać Sól?
Generalnie, wzór soli składa się z dwóch części: kationu (jonu dodatniego) pochodzącego z zasady i anionu (jonu ujemnego) pochodzącego z kwasu. Spróbujmy to uprościć:
- Kationy: Najczęściej metale (np. Na+, K+, Ca2+, Mg2+, Al3+) lub grupa amonowa (NH4+).
- Aniony: Pochodzą od kwasów (np. Cl-, SO42-, NO3-, PO43-).
Przykład: NaCl – kation to Na+ (sód), a anion to Cl- (chlorek).
Ważne: Ładunki kationu i anionu muszą się zrównoważyć, aby sól była elektrycznie obojętna. Dlatego np. chlorek wapnia ma wzór CaCl2, ponieważ wapń ma ładunek 2+, a chlorek 1-.
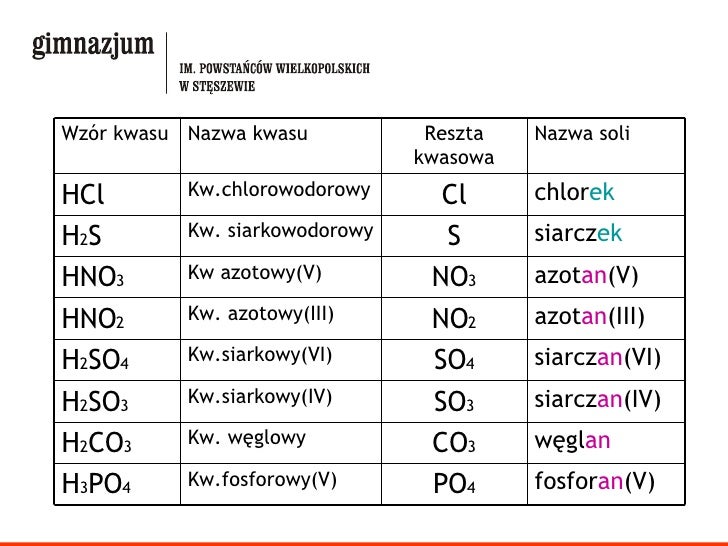
Nazewnictwo Soli - Krok po Kroku
Nazwa soli składa się z dwóch części: nazwy anionu (pochodzącej od kwasu) i nazwy kationu (pochodzącej od zasady). Najczęściej nazwy anionów tworzy się przez dodanie końcówki "-ek" do rdzenia nazwy kwasu, a nazwy kationów pochodzą bezpośrednio od nazwy metalu.
- Sole kwasów beztlenowych: Zakończenie "-ek" (np. chlorek, siarczek, fluorek).
- Sole kwasów tlenowych: Zakończenia "-an" lub "-yn" (np. siarczan, azotan, fosforan, siarczyn, azotyn).
Przykład:
- H2SO4 (kwas siarkowy(VI)) → SO42- (siarczan(VI)) → Na2SO4 (siarczan(VI) sodu)
- HNO3 (kwas azotowy(V)) → NO3- (azotan(V)) → KNO3 (azotan(V) potasu)
W przypadku metali, które mogą przyjmować różne wartościowości, po nazwie metalu w nawiasie podaje się jego wartościowość cyframi rzymskimi. Na przykład:
- FeCl2 – chlorek żelaza(II)
- FeCl3 – chlorek żelaza(III)
Przykłady Najważniejszych Soli i Ich Zastosowań
Poniżej znajduje się kilka przykładów soli, które warto znać, wraz z ich wzorami i zastosowaniami:
- NaCl (chlorek sodu): Sól kuchenna, przyprawa, konserwant, surowiec w przemyśle chemicznym.
- NaHCO3 (wodorowęglan sodu): Soda oczyszczona, dodatek do żywności (spulchniacz), środek zobojętniający kwasy żołądkowe.
- Na2CO3 (węglan sodu): Soda kalcynowana, środek czyszczący, zmiękczacz wody.
- CaCO3 (węglan wapnia): Kreda, wapień, składnik cementu, suplement diety.
- MgSO4 (siarczan magnezu): Sól gorzka, środek przeczyszczający, nawóz, dodatek do kąpieli.
- KNO3 (azotan potasu): Saletra potasowa, nawóz, składnik prochu czarnego.
- (NH4)2SO4 (siarczan amonu): Nawóz azotowy.
Ta lista to tylko wierzchołek góry lodowej. Istnieje mnóstwo innych soli o różnych właściwościach i zastosowaniach.
Sole Kwaśne i Zasadowe
Warto wspomnieć, że istnieją również sole kwaśne i zasadowe. Powstają one, gdy nie wszystkie atomy wodoru w kwasie zostaną zastąpione metalem (sole kwaśne) lub nie wszystkie grupy hydroksylowe wodorotlenku zostaną zastąpione resztą kwasową (sole zasadowe).
Przykład:
- NaHSO4 (wodorosiarczan sodu) - sól kwaśna
- Mg(OH)Cl (wodorochlorek magnezu) - sól zasadowa
Adresowanie Kontrargumentów
Często słyszę argument, że zapamiętywanie wzorów i nazw soli jest bezcelowe, ponieważ w dobie internetu wszystko można szybko znaleźć. Owszem, informacja jest łatwo dostępna, ale znajomość podstawowych zasad nazewnictwa i wzorów chemicznych pozwala na szybsze i bardziej efektywne zrozumienie informacji, a także na krytyczne ocenianie źródeł.
Inny argument to przekonanie, że chemia jest zbyt trudna i niepotrzebna. Uważam jednak, że zrozumienie podstawowych procesów chemicznych zachodzących wokół nas pozwala na bardziej świadome i odpowiedzialne życie.
Bądź Ciekawy! Eksperymentuj!
Najlepszym sposobem na naukę chemii jest eksperymentowanie! Oczywiście, zachowując wszelkie środki ostrożności. Proste doświadczenia, takie jak badanie odczynu pH różnych substancji przy pomocy wskaźników, mogą być fascynujące i pomóc w zrozumieniu właściwości soli.
Pamiętaj: Chemia to nie tylko teoria, ale przede wszystkim praktyka!
Podsumowanie i Co Dalej?
Mamy nadzieję, że ten artykuł pomógł Ci zrozumieć podstawy wzorów i nazw soli. Pamiętaj, że nauka chemii to proces, który wymaga czasu i cierpliwości. Nie zrażaj się trudnościami, eksperymentuj i bądź ciekawy!
Najważniejsze zapamiętać:
- Sól to związek jonowy powstały z reakcji kwasu i zasady.
- Wzór soli składa się z kationu (jon dodatni) i anionu (jon ujemny).
- Nazwa soli składa się z nazwy anionu i nazwy kationu.
- Znajomość soli jest przydatna w wielu dziedzinach życia.
Czy po przeczytaniu tego artykułu czujesz się pewniej w świecie soli? Czy masz ochotę na samodzielne zgłębienie tematu i przeprowadzenie prostych eksperymentów? Pamiętaj, że nauka to przygoda!





