Wskaż Wzór Soli Która W Roztworze Wodnym Dysocjuje Na Jony

Sól, w chemii, to związek chemiczny powstały w wyniku reakcji zobojętniania kwasu zasadą. Mówiąc prościej, to produkt reakcji kwasu z wodorotlenkiem, w której jon wodorowy kwasu zostaje zastąpiony kationem metalu lub grupą amonową. Sole są niezwykle powszechne w naszym otoczeniu, od chlorku sodu (soli kuchennej) po rozmaite minerały budujące skorupę ziemską. Ale co się dzieje, gdy sól trafi do wody? Wiele soli ulega procesowi dysocjacji jonowej.
Dysocjacja jonowa to proces rozpadu związku chemicznego na jony pod wpływem rozpuszczalnika polarnego, takiego jak woda. Woda, dzięki swojej budowie (cząsteczka polarna), oddziałuje na jony tworzące sieć krystaliczną soli, osłabiając wiązania między nimi i powodując ich oddzielenie. Jony te, otoczone cząsteczkami wody (hydratowane), swobodnie poruszają się w roztworze, nadając mu właściwości przewodzące prąd elektryczny.
Zatem, jaki wzór soli wskazuje na to, że w roztworze wodnym nastąpi dysocjacja na jony? Odpowiedź brzmi: większość soli. Dysocjacji jonowej ulegają sole dobrze rozpuszczalne w wodzie. Rozpuszczalność soli zależy od wielu czynników, takich jak rodzaj metalu, rodzaj anionu, temperatura oraz obecność innych jonów w roztworze.
Warto jednak pamiętać, że nie wszystkie sole dysocjują w takim samym stopniu. Sole mocnych kwasów i mocnych zasad dysocjują w roztworach wodnych praktycznie całkowicie. Oznacza to, że w roztworze obecne są niemal wyłącznie jony, a stężenie niezdysocjowanej soli jest bardzo niskie. Przykładem takiej soli jest chlorek sodu (NaCl).
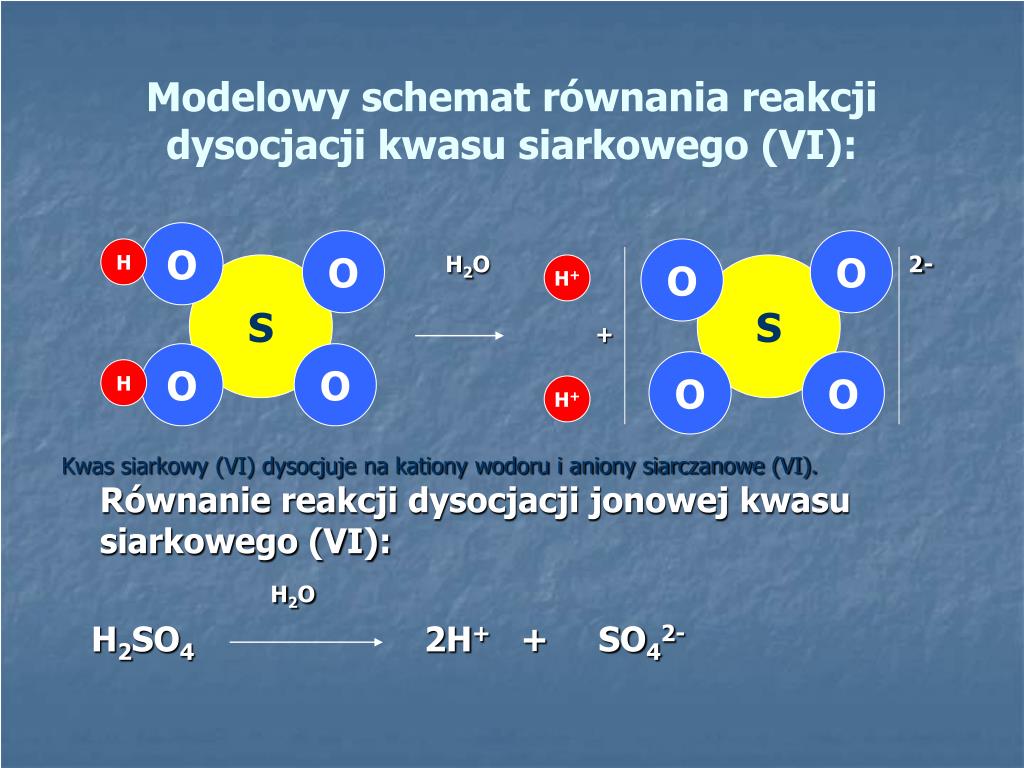
NaCl, wrzucony do wody, rozpada się na kationy sodu (Na+) i aniony chlorkowe (Cl-):
NaCl (s) --(H2O)--> Na+ (aq) + Cl- (aq)
"s" oznacza stan stały (sól w postaci krystalicznej), a "aq" oznacza, że jony są uwodnione (otoczone cząsteczkami wody).
Inne przykłady soli, które dobrze dysocjują w wodzie to azotan potasu (KNO3), siarczan sodu (Na2SO4) i chlorek potasu (KCl).
Z kolei sole słabych kwasów i słabych zasad dysocjują w mniejszym stopniu. W roztworze oprócz jonów obecne są również niezdysocjowane cząsteczki soli. Przykładem takiej soli jest octan amonu (CH3COONH4).
CH3COONH4 (s) --(H2O)--> CH3COO- (aq) + NH4+ (aq)
W tym przypadku proces dysocjacji jest odwracalny, co oznacza, że jony octanowe i amonowe mogą łączyć się z powrotem, tworząc niezdysocjowane cząsteczki octanu amonu. Ustalana jest pewna równowaga dynamiczna.
Istnieją także sole trudno rozpuszczalne w wodzie. Dysocjacja takich soli zachodzi w bardzo niewielkim stopniu. Przykładem jest chlorek srebra (AgCl).
AgCl (s) <--(H2O)--> Ag+ (aq) + Cl- (aq)
Równowaga jest silnie przesunięta w lewo, co oznacza, że w roztworze znajduje się bardzo mało jonów srebra i chlorkowych. Zazwyczaj do opisania rozpuszczalności takich soli używa się pojęcia iloczynu rozpuszczalności.
Na zdolność soli do dysocjacji wpływa również temperatura. Zazwyczaj wraz ze wzrostem temperatury rozpuszczalność soli rośnie, a co za tym idzie, wzrasta również stopień dysocjacji. Energia cieplna dostarczana do roztworu ułatwia rozerwanie wiązań jonowych w sieci krystalicznej soli.
Należy też wspomnieć o wpływie stężenia roztworu na stopień dysocjacji. Zgodnie z prawem rozcieńczeń Ostwalda, stopień dysocjacji elektrolitu słabego (czyli soli, która dysocjuje w niewielkim stopniu) wzrasta wraz z rozcieńczeniem roztworu.
Podsumowując, wzór soli, która w roztworze wodnym dysocjuje na jony, to przede wszystkim wzór soli dobrze rozpuszczalnej w wodzie. Proces dysocjacji zależy jednak od wielu czynników, takich jak rodzaj soli, temperatura, stężenie roztworu oraz obecność innych jonów.
H2 Sole, które dysocjują w roztworach wodnych, odgrywają kluczową rolę w wielu procesach chemicznych i biologicznych. Jony obecne w roztworach soli przewodzą prąd elektryczny, co jest wykorzystywane w elektrolizie, akumulatorach i ogniwach paliwowych. Są one również niezbędne dla funkcjonowania organizmów żywych, biorąc udział w regulacji ciśnienia osmotycznego, przewodzeniu impulsów nerwowych i wielu innych procesach.
Dysocjacja soli w wodzie jest także ważna w kontekście ochrony środowiska. Obecność jonów w wodach gruntowych i powierzchniowych wpływa na ich właściwości fizykochemiczne i ma znaczenie dla życia organizmów wodnych. Zanieczyszczenie wód jonami metali ciężkich może prowadzić do poważnych problemów ekologicznych.
Zrozumienie procesu dysocjacji soli jest zatem kluczowe dla wielu dziedzin nauki i technologii.
Warto również pamiętać, że istnieją sole, które w roztworze wodnym ulegają hydrolizie. Hydroliza to reakcja soli z wodą, w wyniku której powstaje kwas i zasada. Jeśli sól pochodzi od słabego kwasu i mocnej zasady, roztwór będzie miał odczyn zasadowy. Jeśli sól pochodzi od mocnego kwasu i słabej zasady, roztwór będzie miał odczyn kwasowy. Jeśli sól pochodzi od słabego kwasu i słabej zasady, odczyn roztworu zależy od siły kwasu i zasady.