Wodorotlenki Zadania I Odpowiedzi

Zastanawiasz się, czym właściwie są wodorotlenki i jak rozwiązywać zadania z nimi związane? To artykuł stworzony specjalnie dla Ciebie! Niezależnie od tego, czy jesteś uczniem szkoły średniej, przygotowujesz się do matury z chemii, czy po prostu chcesz odświeżyć swoją wiedzę, znajdziesz tutaj przystępne wyjaśnienia, praktyczne przykłady i rozwiązania zadań, które pomogą Ci zrozumieć to zagadnienie.
Wodorotlenki – Co to takiego?
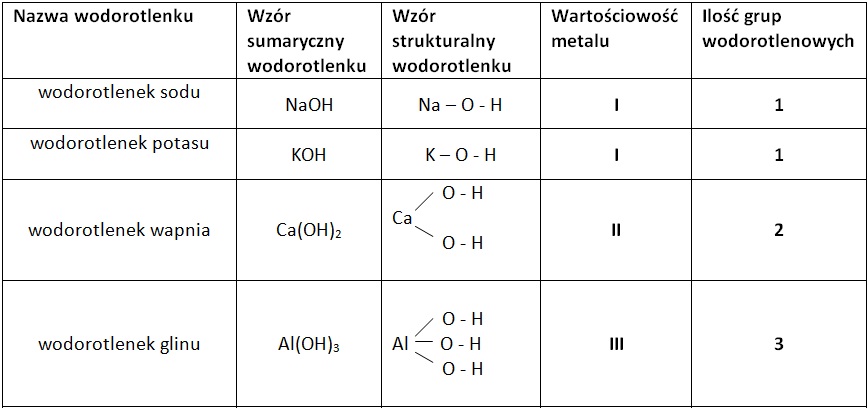
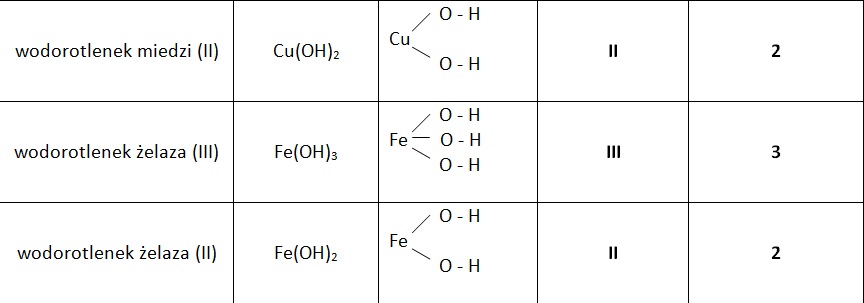
Najprościej mówiąc, wodorotlenki to związki chemiczne, które zawierają grupę wodorotlenową (OH-) związaną z metalem. Ta obecność grupy OH- determinuje ich charakter zasadowy. Często nazywane są zasadami (zwłaszcza w roztworach wodnych), choć warto pamiętać, że termin "zasada" ma również szersze znaczenie w chemii.
Jak powstają wodorotlenki?
Wodorotlenki mogą powstawać w wyniku różnych reakcji, najczęściej:
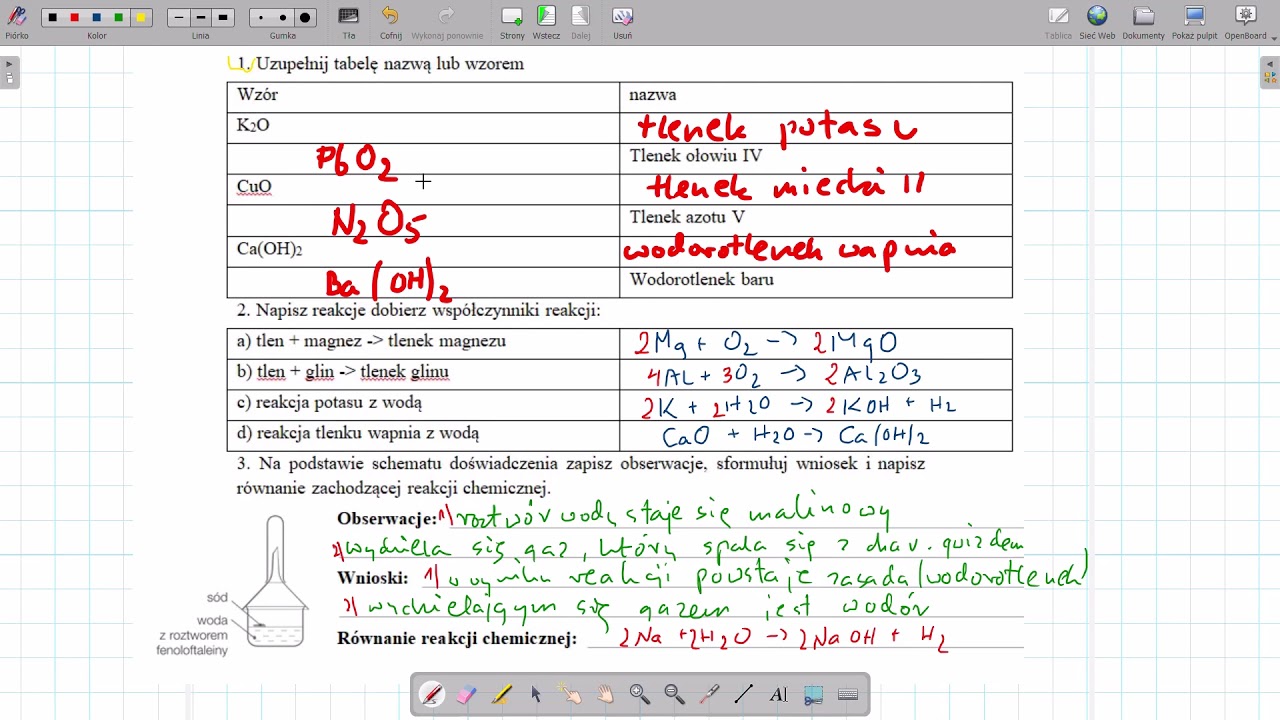
- Reakcji metalu z wodą: Nie wszystkie metale reagują z wodą w ten sam sposób. Metale alkaliczne (np. lit, sód, potas) reagują bardzo gwałtownie, tworząc wodorotlenek i wodór. Na przykład: 2Na + 2H2O → 2NaOH + H2. Metale ziem alkalicznych (np. wapń, stront, bar) reagują mniej gwałtownie.
- Reakcji tlenku metalu z wodą: Tlenki metali alkalicznych i ziem alkalicznych reagują z wodą, tworząc wodorotlenki. Na przykład: CaO + H2O → Ca(OH)2.
Właściwości wodorotlenków:
- Stan skupienia: W temperaturze pokojowej większość wodorotlenków metali jest substancjami stałymi.
- Rozpuszczalność w wodzie: Nie wszystkie wodorotlenki są dobrze rozpuszczalne w wodzie. Rozpuszczalność wodorotlenków metali alkalicznych jest zazwyczaj dobra, natomiast rozpuszczalność wodorotlenków innych metali jest często ograniczona. Informacje o rozpuszczalności można znaleźć w tablicach rozpuszczalności.
- Odczyn: Roztwory wodne wodorotlenków mają odczyn zasadowy, co oznacza, że pH jest większe niż 7.
- Działanie żrące: Wodorotlenki, zwłaszcza te o wysokim stężeniu, są żrące i mogą powodować poważne oparzenia skóry i uszkodzenia oczu. Należy zachować ostrożność podczas pracy z nimi.
Zadania z wodorotlenków – Przykłady i Rozwiązania
Przejdźmy teraz do konkretnych przykładów zadań, które pomogą Ci zrozumieć, jak stosować wiedzę o wodorotlenkach w praktyce. Skupimy się na obliczeniach stechiometrycznych i zadaniach związanych z neutralizacją.
Przykład 1: Obliczanie masy molowej wodorotlenku
Zadanie: Oblicz masę molową wodorotlenku potasu (KOH).
Rozwiązanie:
Aby obliczyć masę molową KOH, musimy zsumować masy atomowe każdego z pierwiastków wchodzących w skład związku. Korzystamy z układu okresowego pierwiastków:
- Masa atomowa potasu (K) ≈ 39,10 u
- Masa atomowa tlenu (O) ≈ 16,00 u
- Masa atomowa wodoru (H) ≈ 1,01 u
Zatem masa molowa KOH wynosi: 39,10 + 16,00 + 1,01 = 56,11 g/mol.
Przykład 2: Reakcja neutralizacji
Zadanie: Oblicz, ile gramów wodorotlenku sodu (NaOH) potrzeba do zobojętnienia 100 ml roztworu kwasu solnego (HCl) o stężeniu 0,1 mol/dm3.
Rozwiązanie:
Najpierw musimy napisać równanie reakcji neutralizacji:
NaOH + HCl → NaCl + H2O
Z równania wynika, że 1 mol NaOH reaguje z 1 molem HCl. Teraz obliczmy, ile moli HCl znajduje się w 100 ml roztworu o stężeniu 0,1 mol/dm3.
1 dm3 = 1000 ml
Zatem 100 ml = 0,1 dm3
Liczba moli HCl = stężenie * objętość = 0,1 mol/dm3 * 0,1 dm3 = 0,01 mol
Skoro do zobojętnienia 0,01 mola HCl potrzeba 0,01 mola NaOH, musimy obliczyć masę 0,01 mola NaOH.
Masa molowa NaOH = 22,99 (Na) + 16,00 (O) + 1,01 (H) = 40,00 g/mol
Masa NaOH potrzebna do zobojętnienia = liczba moli * masa molowa = 0,01 mol * 40,00 g/mol = 0,4 g
Odpowiedź: Do zobojętnienia 100 ml roztworu HCl o stężeniu 0,1 mol/dm3 potrzeba 0,4 g NaOH.
Przykład 3: Obliczanie pH roztworu wodorotlenku
Zadanie: Oblicz pH roztworu wodorotlenku potasu (KOH) o stężeniu 0,001 mol/dm3.
Rozwiązanie:
Ponieważ KOH jest silnym wodorotlenkiem, całkowicie dysocjuje w wodzie:
KOH → K+ + OH-
Stężenie jonów OH- w roztworze jest równe stężeniu KOH, czyli [OH-] = 0,001 mol/dm3.
Najpierw obliczamy pOH roztworu:
pOH = -log[OH-] = -log(0,001) = 3
Następnie, korzystając z zależności pH + pOH = 14, obliczamy pH:
pH = 14 - pOH = 14 - 3 = 11
Odpowiedź: pH roztworu KOH o stężeniu 0,001 mol/dm3 wynosi 11.
Praktyczne Zastosowania Wodorotlenków
Wodorotlenki znajdują szerokie zastosowanie w różnych dziedzinach. Oto kilka przykładów:
- Przemysł chemiczny: NaOH (wodorotlenek sodu) jest używany do produkcji mydła, detergentów, papieru, włókien sztucznych i wielu innych produktów.
- Przemysł spożywczy: NaOH jest używany do oczyszczania rur kanalizacyjnych, a także w procesach produkcyjnych niektórych produktów spożywczych (np. do obróbki precli). Ca(OH)2 (wodorotlenek wapnia) jest używany do produkcji wody wapiennej.
- Oczyszczanie ścieków: Wodorotlenki są używane do neutralizacji kwaśnych ścieków i usuwania metali ciężkich.
- Budownictwo: Ca(OH)2 (wodorotlenek wapnia, wapno gaszone) jest składnikiem zapraw murarskich i tynków.
- Medycyna: Wodorotlenek magnezu (Mg(OH)2) jest składnikiem leków zobojętniających kwas żołądkowy.
Wskazówki i Porady
- Zrozumienie pojęć: Upewnij się, że dobrze rozumiesz definicje podstawowych pojęć, takich jak masa molowa, stężenie molowe, pH, pOH, reakcja neutralizacji.
- Pisanie równań reakcji: Zawsze pisz poprawnie zbilansowane równania reakcji chemicznych. To podstawa do poprawnego rozwiązywania zadań stechiometrycznych.
- Tablice rozpuszczalności: Korzystaj z tablic rozpuszczalności, aby sprawdzić, czy dany wodorotlenek jest rozpuszczalny w wodzie.
- Pamiętaj o jednostkach: Zwracaj uwagę na jednostki miar i upewnij się, że są one spójne w obliczeniach.
- Ćwicz regularnie: Rozwiązuj jak najwięcej zadań, aby utrwalić swoją wiedzę i umiejętności.
- Korzystaj z zasobów internetowych: Istnieje wiele stron internetowych i filmów edukacyjnych, które mogą pomóc Ci w nauce chemii. Szukaj interaktywnych symulacji i quizów, które pozwolą Ci sprawdzić swoją wiedzę w praktyce.
Podsumowanie
Wodorotlenki to ważna grupa związków chemicznych o szerokim spektrum zastosowań. Zrozumienie ich właściwości i umiejętność rozwiązywania zadań z nimi związanych jest kluczowe dla każdego, kto interesuje się chemią. Mam nadzieję, że ten artykuł pomógł Ci zrozumieć to zagadnienie i dostarczył praktycznych wskazówek, które pomogą Ci w nauce.
Pamiętaj, że kluczem do sukcesu jest systematyczna nauka i rozwiązywanie zadań. Nie bój się pytać o pomoc, jeśli masz jakiekolwiek wątpliwości. Powodzenia!