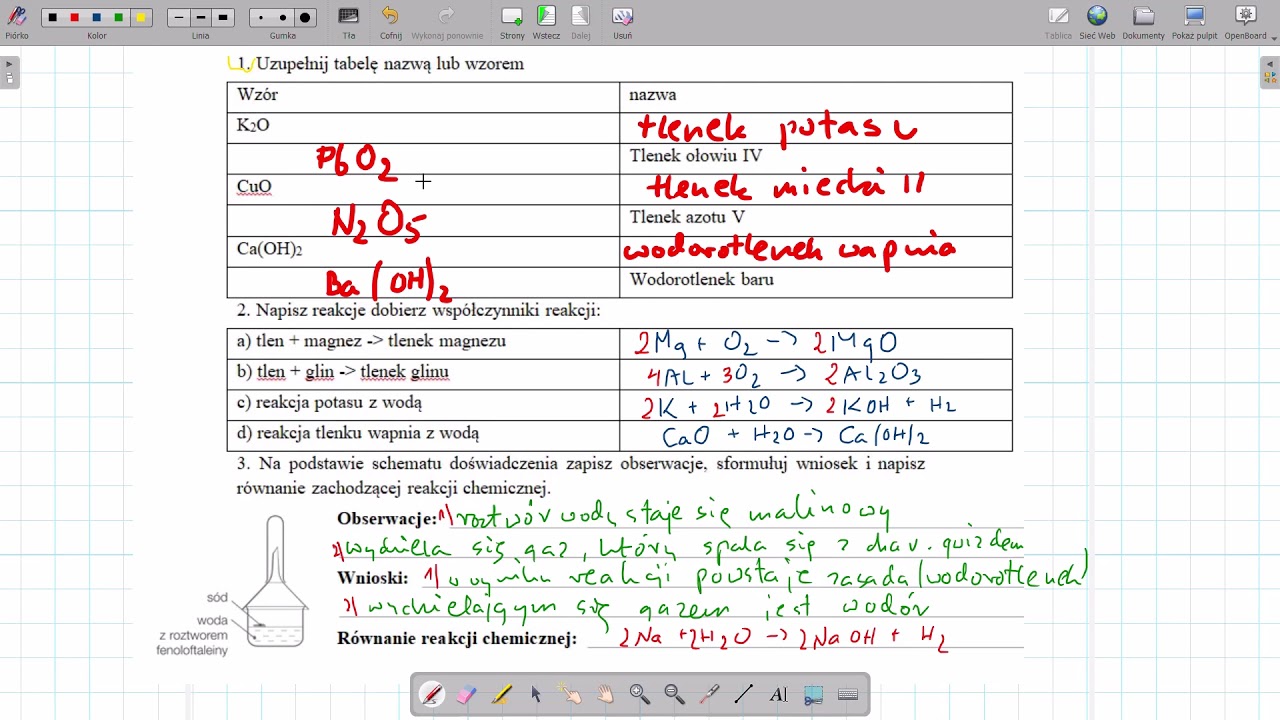
Wodorotlenki Sprawdzian 2 Gimnazjum Edukompas

Wodorotlenki to jedne z ważniejszych związków chemicznych, z którymi spotykamy się w życiu codziennym i które odgrywają znaczącą rolę w przemyśle. Zrozumienie ich właściwości i reakcji jest kluczowe, szczególnie dla uczniów gimnazjum przygotowujących się do sprawdzianu. Ten artykuł pomoże uporządkować wiedzę na temat wodorotlenków, koncentrując się na zagadnieniach często pojawiających się na sprawdzianach Edukompas.
Podstawowe Definicje i Budowa Wodorotlenków
Czym są wodorotlenki?
Wodorotlenki to związki chemiczne, które zawierają metal (lub kation amonu – NH₄⁺) połączony z jedną lub więcej grupami wodorotlenowymi (OH⁻). Ich ogólny wzór to M(OH)ₓ, gdzie M reprezentuje metal, a x oznacza wartościowość metalu.
Budowa i wiązania
Grupa wodorotlenowa (OH⁻) charakteryzuje się ujemnym ładunkiem elektrycznym. Wiązanie pomiędzy metalem a grupą wodorotlenową jest zwykle jonowe (zwłaszcza w przypadku metali z grup 1 i 2 układu okresowego). Wiązania wodorotlenków są polarne, co wpływa na ich rozpuszczalność w wodzie.
Nazewnictwo wodorotlenków
Nazwa wodorotlenku składa się z dwóch członów: "wodorotlenek" i nazwa metalu w dopełniaczu. Jeśli metal występuje na różnych stopniach utlenienia, należy podać jego wartościowość w nawiasie, np. wodorotlenek żelaza(II) – Fe(OH)₂ i wodorotlenek żelaza(III) – Fe(OH)₃.
Właściwości Wodorotlenków
Rozpuszczalność w wodzie
Rozpuszczalność wodorotlenków w wodzie jest zróżnicowana. Wodorotlenki litowców (grupa 1) są z reguły dobrze rozpuszczalne w wodzie. Wodorotlenki berylowców (grupa 2) są słabo rozpuszczalne lub praktycznie nierozpuszczalne, z wyjątkiem wodorotlenku baru (Ba(OH)₂), który jest dobrze rozpuszczalny.
Charakter zasadowy
Rozpuszczalne wodorotlenki to zasady. Rozpuszczając się w wodzie, dysocjują na jony metalu (M⁺) i jony wodorotlenowe (OH⁻). Obecność jonów OH⁻ powoduje, że roztwory wodorotlenków mają odczyn zasadowy.
Wskaźniki
Wodorotlenki zmieniają barwę wskaźników: fenoloftaleina staje się malinowa, a oranż metylowy żółty w roztworach zasadowych. Papierki wskaźnikowe uniwersalne barwią się na niebiesko lub fioletowo.
Otrzymywanie Wodorotlenków
Reakcja metalu z wodą
Metale aktywne (np. litowce) reagują z wodą tworząc wodorotlenki i wodór: 2Na + 2H₂O → 2NaOH + H₂.
Reakcja tlenku metalu z wodą
Tlenki metali, które tworzą zasady, reagują z wodą, tworząc wodorotlenki: CaO + H₂O → Ca(OH)₂.
Reakcja soli z zasadą
Wodorotlenki nierozpuszczalne w wodzie można otrzymać w reakcji soli z zasadą. Warunkiem jest, aby powstały wodorotlenek był nierozpuszczalny i wypadł z roztworu w postaci osadu: CuSO₄ + 2NaOH → Cu(OH)₂↓ + Na₂SO₄.
Reakcje Charakterystyczne Wodorotlenków
Reakcje zobojętniania
Wodorotlenki reagują z kwasami w reakcji zobojętniania, tworząc sól i wodę: NaOH + HCl → NaCl + H₂O.
Reakcja z tlenkami kwasowymi
Wodorotlenki reagują z tlenkami kwasowymi, tworząc sole: 2NaOH + CO₂ → Na₂CO₃ + H₂O.
Reakcje strącania osadów
Niektóre wodorotlenki są nierozpuszczalne w wodzie. Dodanie roztworu zasady do roztworu soli zawierającej odpowiedni kation spowoduje wytrącenie się osadu wodorotlenku.
Przykłady Wodorotlenków i ich Zastosowania
Wodorotlenek sodu (NaOH)
Znany również jako soda kaustyczna. Wykorzystywany w przemyśle chemicznym, papierniczym, tekstylnym, a także do produkcji mydła i detergentów. Jest bardzo żrący i należy zachować ostrożność podczas jego używania.
Wodorotlenek potasu (KOH)
Wykorzystywany w produkcji mydła potasowego (mydło miękkie), w akumulatorach alkalicznych oraz w przemyśle chemicznym.
Wodorotlenek wapnia (Ca(OH)₂)
Znany jako wapno gaszone. Stosowany w budownictwie, rolnictwie (do odkwaszania gleby) oraz w procesach oczyszczania wody.
Wodorotlenek magnezu (Mg(OH)₂)
Składnik niektórych leków zobojętniających kwas żołądkowy oraz środków przeczyszczających. Znajduje się również w pastach do zębów.
Przykładowe Zadania Sprawdzianowe
Typowe zadania na sprawdzianie Edukompas mogą dotyczyć:
- Określania wzoru sumarycznego wodorotlenku na podstawie jego nazwy.
- Zapisywania równań reakcji otrzymywania wodorotlenków.
- Rozpoznawania charakteru (kwasowy, zasadowy, obojętny) roztworów wodorotlenków.
- Wyjaśniania wpływu wodorotlenków na barwę wskaźników.
- Identyfikacji wodorotlenków na podstawie reakcji charakterystycznych.
Podsumowanie
Zrozumienie podstawowych definicji, właściwości, sposobów otrzymywania i reakcji wodorotlenków jest kluczowe do pomyślnego zdania sprawdzianu. Pamiętaj o powtarzaniu wzorów, równań reakcji oraz o analizowaniu przykładów zastosowań wodorotlenków w życiu codziennym i przemyśle. Powodzenia na sprawdzianie!
![Wodorotlenki Sprawdzian 2 Gimnazjum Edukompas SPRAWDZIAN Chemia. Klasa 7: Tlenki i wodorotlenki [5] - YouTube](https://i.ytimg.com/vi/lB-CSds7Eik/maxresdefault.jpg?sqp=-oaymwEmCIAKENAF8quKqQMa8AEB-AH-CYAC0AWKAgwIABABGGUgZShlMA8=&rs=AOn4CLBHWE0z9H8yRycaPTPRqUIQ2BXF2A)
