Wodorotlenki Równania Reakcji

Wodorotlenki stanowią niezwykle istotną grupę związków chemicznych, odgrywającą kluczową rolę w wielu procesach przemysłowych, laboratoryjnych, a nawet w naszym codziennym życiu. Ich charakterystyczną cechą jest obecność grupy hydroksylowej (OH-), która determinuje ich właściwości i reaktywność. Zrozumienie równań reakcji z udziałem wodorotlenków jest fundamentalne dla chemików, inżynierów i wszystkich zainteresowanych naukami przyrodniczymi.
Charakterystyka i Podział Wodorotlenków
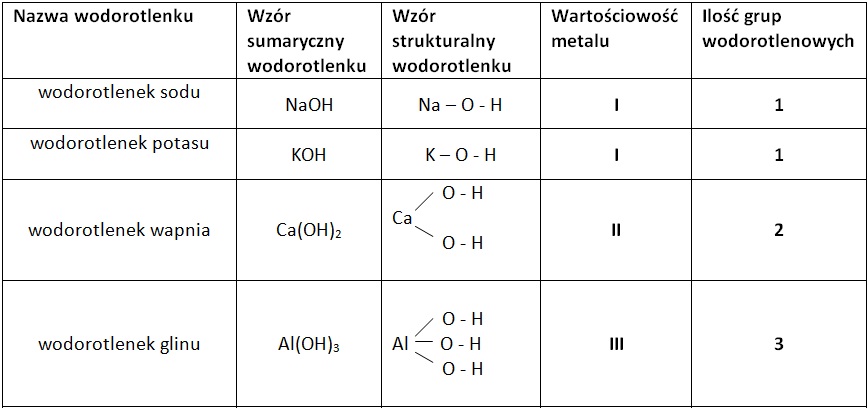
Wodorotlenki to związki chemiczne, które w swojej strukturze zawierają jedną lub więcej grup hydroksylowych (OH-) połączonych z atomem metalu (w przypadku wodorotlenków metali) lub rzadziej z atomem niemetalu (wodorotlenki amfoteryczne). Generalny wzór wodorotlenku to M(OH)n, gdzie M to metal, a n to jego wartościowość.
Ze względu na zachowanie w roztworach wodnych, wodorotlenki dzielimy na:
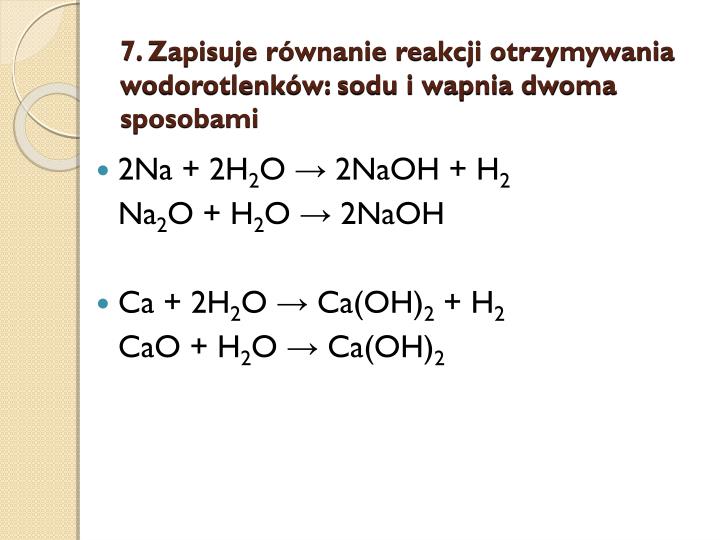
- Wodorotlenki zasadowe: Tworzone przez metale alkaliczne (np. NaOH, KOH) i metale ziem alkalicznych (np. Ca(OH)2, Ba(OH)2). Rozpuszczają się w wodzie, tworząc silnie zasadowe roztwory, czyli roztwory o wysokim pH (powyżej 7).
- Wodorotlenki amfoteryczne: Reagują zarówno z kwasami, jak i z zasadami. Przykładem jest Al(OH)3 i Zn(OH)2. Ich zachowanie zależy od warunków reakcji.
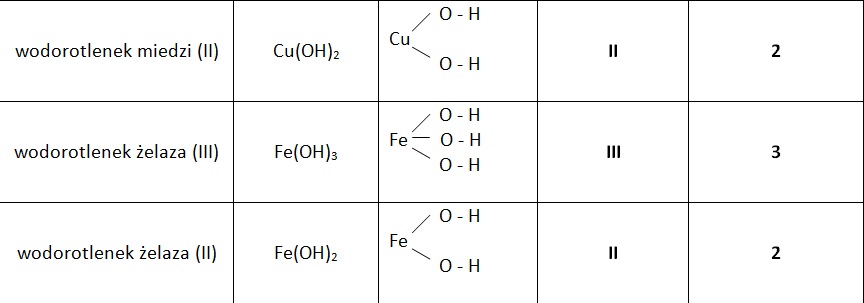
- Wodorotlenki nierozpuszczalne: Większość wodorotlenków metali przejściowych i niektórych metali bloku p (np. Fe(OH)3, Cu(OH)2) są praktycznie nierozpuszczalne w wodzie.
Dysocjacja Jonowa Wodorotlenków
Wodorotlenki zasadowe, rozpuszczając się w wodzie, ulegają dysocjacji jonowej, czyli rozpadowi na jony. Proces ten można przedstawić następującym równaniem:
M(OH)n → Mn+ + nOH-
Gdzie:
- Mn+ to kation metalu o ładunku n+
- OH- to anion wodorotlenkowy
Obecność jonów OH- w roztworze powoduje, że roztwór ma charakter zasadowy i wykazuje specyficzne właściwości, takie jak:
- Zdolność do neutralizacji kwasów.
- Zmiana barwy wskaźników (np. fenoloftaleina barwi się na malinowo w roztworach zasadowych).
- Śliskość w dotyku (ostrożnie!).
Równania Reakcji z Udziałem Wodorotlenków
Wodorotlenki uczestniczą w wielu reakcjach chemicznych, z których najważniejsze to:
Neutralizacja
Reakcja neutralizacji to reakcja kwasu z zasadą, w wyniku której powstaje sól i woda. Jest to reakcja jonowa, w której jony wodorowe (H+) z kwasu łączą się z jonami wodorotlenkowymi (OH-) z wodorotlenku, tworząc wodę (H2O). Przykładowe równanie reakcji neutralizacji:
HCl + NaOH → NaCl + H2O
W tym przypadku kwas solny (HCl) reaguje z wodorotlenkiem sodu (NaOH), tworząc chlorek sodu (NaCl, sól kuchenna) i wodę.
Reakcja neutralizacji jest egzotermiczna, co oznacza, że wydziela się ciepło.
Reakcje z Tlenkami Kwasowymi
Wodorotlenki reagują z tlenkami kwasowymi (bezwodnikami kwasowymi), tworząc sole. Tlenki kwasowe to tlenki niemetali, które po reakcji z wodą tworzą kwasy. Przykładowe równanie reakcji:
CO2 + 2NaOH → Na2CO3 + H2O
W tym przypadku dwutlenek węgla (CO2, tlenek kwasowy) reaguje z wodorotlenkiem sodu (NaOH), tworząc węglan sodu (Na2CO3) i wodę.
Reakcje z Tlenkami Amfoterycznymi
Wodorotlenki, jako zasady, reagują również z tlenkami amfoterycznymi, zachowując się w tej reakcji jak kwasy. Rodzaj powstałego produktu zależy od stężeń reagentów i warunków reakcji. Przykład:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
W tym przypadku tlenek glinu (Al2O3), który jest tlenkiem amfoterycznym, reaguje z wodorotlenkiem sodu tworząc tetrahydroksoglinian sodu.
Reakcje Strąceniowe
Niektóre wodorotlenki są nierozpuszczalne w wodzie. Jeśli w roztworze znajdują się jony metali, które tworzą nierozpuszczalne wodorotlenki, to po dodaniu roztworu zawierającego jony OH- nastąpi wytrącenie osadu. Przykładowe równanie reakcji:
Cu2+(aq) + 2OH-(aq) → Cu(OH)2(s)
W tym przypadku jony miedzi(II) (Cu2+) reagują z jonami wodorotlenkowymi (OH-), tworząc nierozpuszczalny wodorotlenek miedzi(II) (Cu(OH)2), który wytrąca się z roztworu w postaci niebieskiego osadu. Indeks (aq) oznacza, że jon znajduje się w roztworze wodnym, a (s) oznacza, że związek jest w stanie stałym (osad).
Reakcje Wodorotlenków Amfoterycznych
Wodorotlenki amfoteryczne, takie jak Al(OH)3 czy Zn(OH)2, wykazują dwoisty charakter – reagują zarówno z kwasami, jak i z zasadami. Z kwasami reagują jak typowe wodorotlenki, tworząc sole i wodę. Z zasadami tworzą związki kompleksowe. Przykład reakcji z zasadą:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
W tym przypadku wodorotlenek cynku reaguje z wodorotlenkiem sodu, tworząc tetrahydroksocynkan sodu, związek kompleksowy rozpuszczalny w wodzie.
Znaczenie Wodorotlenków w Praktyce
Wodorotlenki znajdują szerokie zastosowanie w różnych dziedzinach:
- Przemysł chemiczny: Wodorotlenek sodu (NaOH) jest używany do produkcji mydła, papieru, włókien sztucznych, a także do oczyszczania ropy naftowej.
- Oczyszczanie ścieków: Wodorotlenek wapnia (Ca(OH)2, wapno gaszone) jest stosowany do neutralizacji kwasów w ściekach i do usuwania fosforanów.
- Budownictwo: Wodorotlenek wapnia jest składnikiem zaprawy murarskiej.
- Farmacja i medycyna: Wodorotlenek magnezu (Mg(OH)2) jest składnikiem leków zobojętniających kwas żołądkowy.
- Analiza chemiczna: Wodorotlenki są stosowane w miareczkowaniu, czyli metodzie oznaczania stężenia kwasów i zasad.
- Górnictwo: Wodorotlenek sodu używany do ługowania boksytów w procesie Bayera, prowadzącym do otrzymywania tlenku glinu.
Przykłady Zastosowań i Równania Reakcji
Produkcja Mydła: Mydła to sole wyższych kwasów tłuszczowych. W procesie zmydlania tłuszczu (estry glicerolu i kwasów tłuszczowych) używa się wodorotlenku sodu lub wodorotlenku potasu. Uproszczone równanie reakcji zmydlania:
(C17H35COO)3C3H5 + 3NaOH → 3C17H35COONa + C3H5(OH)3
Gdzie:
- (C17H35COO)3C3H5 - trioleinian glicerolu (tłuszcz)
- NaOH - wodorotlenek sodu
- C17H35COONa - stearynian sodu (mydło)
- C3H5(OH)3 - glicerol
Oczyszczanie Ścieków: Wodorotlenek wapnia (wapno gaszone) jest używany do usuwania fosforanów ze ścieków, które przyczyniają się do eutrofizacji wód (nadmiernego wzrostu glonów i sinic). Fosforany reagują z wodorotlenkiem wapnia, tworząc nierozpuszczalny fosforan wapnia, który można łatwo oddzielić od wody. Równanie reakcji:
3Ca(OH)2 + 2PO43- → Ca3(PO4)2(s) + 6OH-
Podsumowanie i Perspektywy
Zrozumienie właściwości i reakcji wodorotlenków jest kluczowe dla wielu dziedzin nauki i przemysłu. Od reakcji neutralizacji po strącanie osadów, wodorotlenki odgrywają istotną rolę w procesach chemicznych zachodzących wokół nas. Poznanie równań reakcji z ich udziałem umożliwia kontrolowanie i optymalizowanie tych procesów, co ma bezpośredni wpływ na jakość życia i ochronę środowiska.
Dalsze badania nad wodorotlenkami, w szczególności nad wodorotlenkami amfoterycznymi i ich zastosowaniem w nowych technologiach (np. w ogniwach paliwowych, syntezie nanomateriałów) są niezwykle obiecujące. Zachęcam do dalszego zgłębiania wiedzy na temat tych fascynujących związków chemicznych i ich potencjalnego wpływu na przyszłość.