Wodorotlenki Otrzymywanie

Rozumiem, że chemia, a szczególnie wodorotlenki, mogą wydawać się zawiłe i odległe od codziennego życia. Możliwe, że uczysz się do sprawdzianu, próbujesz zrozumieć procesy zachodzące w twoim domu, a może po prostu ciekawią Cię substancje, które nas otaczają. Bez względu na powód, postaram się przybliżyć temat otrzymywania wodorotlenków w sposób zrozumiały i interesujący, pokazując, że chemia to nie tylko wzory i reakcje, ale przede wszystkim praktyczne zastosowania i wpływ na nasze życie.
Wodorotlenki, choć często kojarzone z niebezpiecznymi substancjami, są niezwykle ważne w wielu dziedzinach. Na przykład, wodorotlenek sodu (NaOH), czyli soda kaustyczna, jest kluczowym składnikiem wielu środków czyszczących, mydeł i detergentów. Wodorotlenek wapnia (Ca(OH)2), czyli wapno gaszone, używany jest w budownictwie, rolnictwie i oczyszczaniu ścieków. Zrozumienie, jak powstają te związki, pozwala nam lepiej kontrolować procesy chemiczne i wykorzystywać je w sposób bezpieczny i efektywny.
Otrzymywanie Wodorotlenków – Wprowadzenie
Wodorotlenki to związki chemiczne, które zawierają grupę hydroksylową (OH-) połączoną z metalem. Generalnie, metale z grup 1 i 2 układu okresowego tworzą wodorotlenki bardzo łatwo. Otrzymywanie wodorotlenków jest kluczowym procesem w wielu gałęziach przemysłu i laboratoriach. Istnieje kilka głównych metod otrzymywania tych związków, a każda z nich ma swoje specyficzne zastosowania i ograniczenia.
Metody Otrzymywania Wodorotlenków
Najpopularniejsze metody otrzymywania wodorotlenków to:
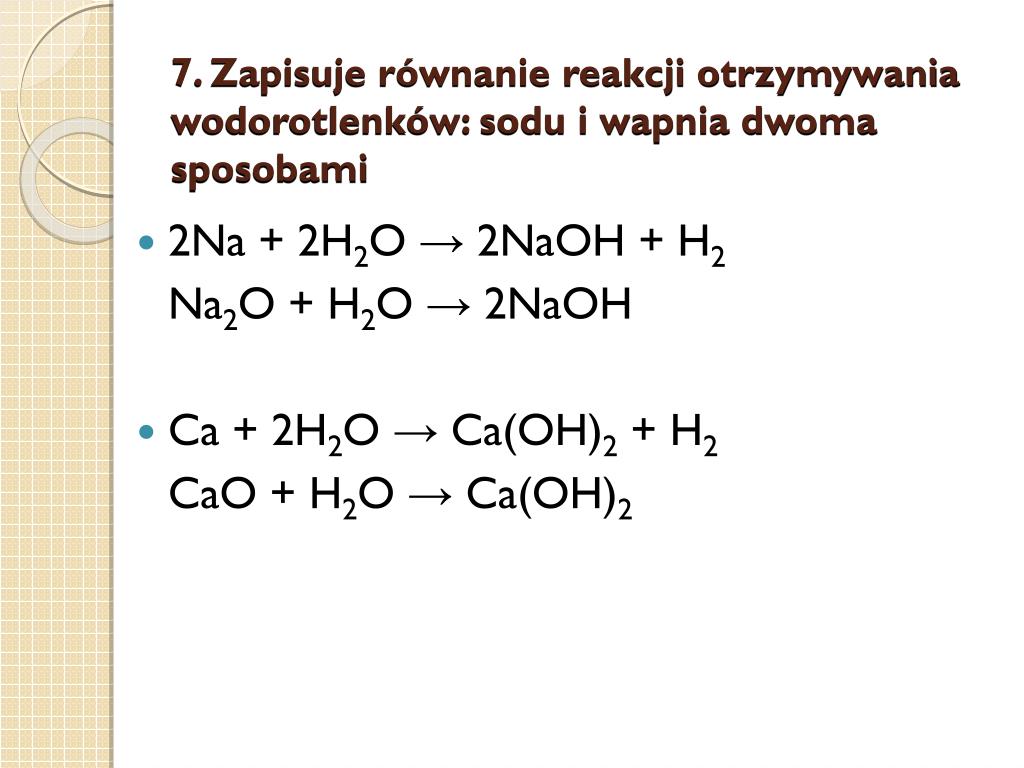
- Reakcja metalu z wodą: Metale z grup 1 i 2 reagują z wodą, tworząc wodorotlenek metalu i wodór.
- Reakcja tlenku metalu z wodą: Tlenki metali z grup 1 i 2 reagują z wodą, tworząc wodorotlenek metalu.
- Elektroliza roztworów soli: Elektroliza wodnych roztworów soli metali alkalicznych i ziem alkalicznych prowadzi do otrzymania wodorotlenków.
- Reakcja soli z wodorotlenkiem: Reakcja soli metalu z mocnym wodorotlenkiem, prowadzi do wytrącenia nierozpuszczalnego wodorotlenku.
Reakcja Metalu z Wodą
Ta metoda jest szczególnie efektywna dla metali alkalicznych (grupa 1) takich jak lit (Li), sód (Na), potas (K), które reagują z wodą bardzo gwałtownie. Reakcja ta jest egzotermiczna, czyli wydziela ciepło, a w przypadku potasu reakcja może być na tyle intensywna, że powoduje zapłon wydzielającego się wodoru.
Przykład:
2 Na(s) + 2 H2O(l) → 2 NaOH(aq) + H2(g)
Sód reaguje z wodą, tworząc wodorotlenek sodu i wodór.
Metale ziem alkalicznych (grupa 2) również reagują z wodą, ale reakcja jest mniej gwałtowna, szczególnie dla berylu (Be) i magnezu (Mg). Wapń (Ca), stront (Sr) i bar (Ba) reagują łatwiej.
Przykład:
Ca(s) + 2 H2O(l) → Ca(OH)2(aq) + H2(g)
Wapń reaguje z wodą, tworząc wodorotlenek wapnia i wodór.
Reakcja Tlenku Metalu z Wodą
Tlenki metali alkalicznych i ziem alkalicznych reagują z wodą, tworząc wodorotlenki. Ta metoda jest często stosowana do otrzymywania wodorotlenków o wysokiej czystości.
Przykład:
Na2O(s) + H2O(l) → 2 NaOH(aq)
Tlenek sodu reaguje z wodą, tworząc wodorotlenek sodu.
CaO(s) + H2O(l) → Ca(OH)2(aq)
Tlenek wapnia (wapno palone) reaguje z wodą, tworząc wodorotlenek wapnia (wapno gaszone).
Elektroliza Roztworów Soli
Elektroliza roztworów soli jest ważną metodą przemysłową, szczególnie do otrzymywania wodorotlenku sodu (NaOH) i chloru (Cl2). Proces ten wykorzystuje prąd elektryczny do rozkładu soli na jony, które następnie reagują z wodą, tworząc wodorotlenek, chlor i wodór.
Przykład:
2 NaCl(aq) + 2 H2O(l) → 2 NaOH(aq) + Cl2(g) + H2(g)
Elektroliza roztworu chlorku sodu prowadzi do powstania wodorotlenku sodu, chloru i wodoru.
Reakcja Soli z Wodorotlenkiem
Ta metoda polega na reakcji rozpuszczalnej soli metalu z rozpuszczalnym wodorotlenkiem. Jeżeli produktem reakcji jest nierozpuszczalny wodorotlenek, to obserwujemy jego wytrącenie z roztworu.
Przykład:
FeCl3(aq) + 3 NaOH(aq) → Fe(OH)3(s) + 3 NaCl(aq)
Chlorek żelaza(III) reaguje z wodorotlenkiem sodu, tworząc nierozpuszczalny wodorotlenek żelaza(III) i chlorek sodu.
Wpływ na Środowisko i Bezpieczeństwo
Otrzymywanie i stosowanie wodorotlenków wiąże się z pewnymi wyzwaniami. Niektóre reakcje, jak reakcja metali z wodą, są bardzo gwałtowne i wymagają zachowania szczególnej ostrożności. Wodorotlenki są substancjami żrącymi i mogą powodować poważne oparzenia skóry i oczu. Ponadto, produkcja wodorotlenków, zwłaszcza elektroliza, może być energochłonna i generować emisje CO2, co wpływa na zmiany klimatyczne. Dlatego ważne jest stosowanie odpowiednich środków ochrony osobistej oraz wdrażanie technologii, które minimalizują negatywny wpływ na środowisko.
Rozwój zrównoważonych metod produkcji wodorotlenków, wykorzystujących odnawialne źródła energii, jest kluczowy dla przyszłości. Badania nad nowymi katalizatorami i procesami elektrochemicznymi mogą znacząco zmniejszyć zużycie energii i emisję szkodliwych substancji. Ważne jest również odpowiedzialne gospodarowanie odpadami i recykling wodorotlenków.
Przeciwwskazania i Alternatywne Poglądy
Niektórzy mogą argumentować, że produkcja wodorotlenków jest niebezpieczna i szkodliwa dla środowiska. Owszem, istnieją zagrożenia związane z tymi procesami, ale korzyści wynikające z zastosowania wodorotlenków w przemyśle, medycynie i ochronie środowiska są ogromne. Bez wodorotlenków nie byłoby możliwe produkowanie wielu niezbędnych produktów, takich jak mydła, detergenty, leki i materiały budowlane. Kluczem jest odpowiedzialne i zrównoważone podejście do produkcji i stosowania wodorotlenków, z uwzględnieniem zasad bezpieczeństwa i ochrony środowiska.
Praktyczne Zastosowania i Przykłady
Wodorotlenki mają szerokie zastosowanie w różnych dziedzinach:
- Przemysł chemiczny: Produkcja mydeł, detergentów, barwników, leków.
- Budownictwo: Produkcja cementu i zapraw murarskich (wapno gaszone).
- Oczyszczanie ścieków: Neutralizacja kwasów i usuwanie zanieczyszczeń.
- Rolnictwo: Regulacja pH gleby (wapno gaszone).
- Przemysł spożywczy: Produkcja żywności (np. wodorotlenek sodu w procesie produkcji precli).
Warto zauważyć, że wodorotlenek magnezu (Mg(OH)2), znany również jako mleczko magnezjowe, jest stosowany jako lek neutralizujący kwasy żołądkowe.
Podsumowanie i Następne Kroki
Otrzymywanie wodorotlenków to złożony, ale niezwykle ważny proces, który ma ogromny wpływ na nasze życie. Zrozumienie różnych metod otrzymywania wodorotlenków, ich właściwości i zastosowań pozwala nam lepiej docenić rolę chemii w naszym świecie. Pamiętajmy jednak o odpowiedzialnym podejściu do tych substancji, z uwzględnieniem zasad bezpieczeństwa i ochrony środowiska. Chemia to nie tylko wzory i reakcje, ale przede wszystkim narzędzie, które możemy wykorzystać do tworzenia lepszego świata.
Zastanów się, w jaki sposób wiedza o wodorotlenkach może wpłynąć na Twoje codzienne decyzje? Czy rozważasz bardziej świadomy wybór środków czystości? A może zainspiruje Cię to do dalszego zgłębiania tajników chemii?




![Wodorotlenki Otrzymywanie Otrzymywanie wodorotlenków #7 [ Kwasy i wodorotlenki ] - YouTube](https://i.ytimg.com/vi/TAYcifqfJ2Y/maxresdefault.jpg)