Wodorotlenki Klasa 7 Zadania

Hej Siódmoklasisto! Rozumiem, że wodorotlenki mogą wydawać się skomplikowane. Pamiętam, kiedy sam zaczynałem uczyć się chemii, czułem się podobnie. Ale nie martw się! Razem przejdziemy przez zadania z wodorotlenków krok po kroku. Zrozumiesz, że to wcale nie jest takie trudne, jak się wydaje. Zaczynamy!
Wodorotlenki – czym właściwie są?
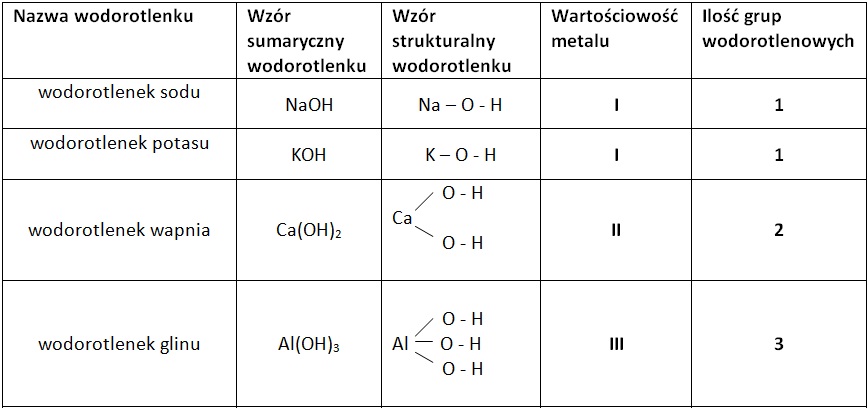
Wodorotlenki to związki chemiczne, które składają się z metalu i grupy wodorotlenowej (OH). Grupa wodorotlenowa to taki "znaczek" chemiczny, który decyduje o właściwościach wodorotlenków. Mają one najczęściej odczyn zasadowy. Kojarzysz mydło albo środki czystości? Często w ich składzie znajdziesz wodorotlenki. To przykład, jak chemia, której się uczysz, wpływa na Twoje codzienne życie!
Ale żeby dobrze rozwiązywać zadania, musimy uporządkować pewne podstawy:
- Wzór ogólny: Metal (Me) - (OH)n, gdzie 'n' to wartościowość metalu.
- Nazewnictwo: Wodorotlenek + nazwa metalu + (wartościowość metalu w nawiasie, jeśli metal ma więcej niż jedną wartościowość).
Dlaczego warto się uczyć o wodorotlenkach?
Wodorotlenki są wszędzie wokół nas! Są wykorzystywane w:
- Produkcji mydła: Wodorotlenek sodu (NaOH) jest kluczowym składnikiem.
- Oczyszczaniu ścieków: Wodorotlenek wapnia (Ca(OH)2) neutralizuje kwasy.
- Budownictwie: Wodorotlenek wapnia (w postaci wapna gaszonego) jest używany do zapraw murarskich.
- Lekach zobojętniających kwas żołądkowy: Wodorotlenek magnezu (Mg(OH)2).
Widzisz więc, że to nie tylko suche definicje, ale realne zastosowania w życiu codziennym i przemyśle! Wiedza o wodorotlenkach pozwala lepiej zrozumieć otaczający nas świat.
Zadania – krok po kroku
Przejdźmy teraz do konkretnych zadań. Rozbijemy je na mniejsze, łatwiejsze do opanowania części. Postaram się używać prostych przykładów, żeby wszystko stało się jasne.
Zadanie 1: Pisanie wzorów sumarycznych wodorotlenków
Załóżmy, że masz napisać wzór sumaryczny wodorotlenku potasu. Jak to zrobić?
- Sprawdzamy symbol potasu: To K.
- Sprawdzamy wartościowość potasu: Potas leży w 1 grupie układu okresowego, więc ma wartościowość I.
- Pisemy wzór: K(OH)1 – ale jedynki się nie pisze, więc ostatecznie wzór to KOH.
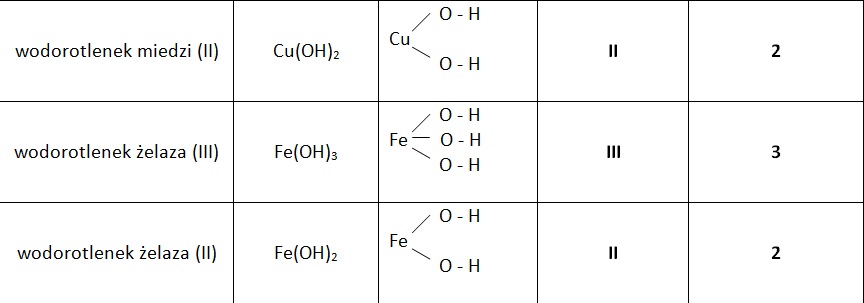
Teraz trudniejszy przykład: Wodorotlenek żelaza(III).
- Symbol żelaza: Fe.
- Wartościowość żelaza: III (podana w nazwie).
- Pisemy wzór: Fe(OH)3.
Pamiętaj! Zawsze sprawdzaj wartościowość metalu. To klucz do poprawnego zapisu wzoru!
Zadanie 2: Nazywanie wodorotlenków
A co, jeśli masz wzór i musisz podać nazwę? To też proste!
Przykład: NaOH
- Sprawdzamy metal: To sód (Na).
- Nazwa: Wodorotlenek sodu.
Przykład: Cu(OH)2
- Sprawdzamy metal: To miedź (Cu).
- Miedź ma dwie wartościowości (I i II), więc musimy określić, która jest w tym przypadku: Skoro są dwie grupy OH, a grupa OH ma zawsze wartościowość I, to miedź ma wartościowość II.
- Nazwa: Wodorotlenek miedzi(II).
Zauważ, że jeśli metal ma więcej niż jedną wartościowość, musisz ją podać w nawiasie po nazwie metalu.
Zadanie 3: Równania reakcji
Równania reakcji to kolejny typ zadań, które mogą sprawiać trudności. Pamiętaj, że w reakcjach chemicznych atomy nie znikają, tylko się przegrupowują. Równanie musi być uzgodnione, czyli liczba atomów każdego pierwiastka musi być taka sama po obu stronach równania.
Przykład: Reakcja metalu z wodą, np. potasu z wodą:
2K + 2H2O → 2KOH + H2
Zwróć uwagę, że po obu stronach równania masz po 2 atomy potasu (K), 4 atomy wodoru (H) i 2 atomy tlenu (O). Równanie jest uzgodnione!
Zadanie 4: Obliczanie masy molowej
Masa molowa to suma mas atomowych wszystkich atomów wchodzących w skład cząsteczki. Znajdziesz ją w układzie okresowym pierwiastków. Jednostką masy molowej jest gram na mol (g/mol).
Przykład: Oblicz masę molową NaOH.
- Masa atomowa Na: 23 g/mol (zaokrąglamy).
- Masa atomowa O: 16 g/mol.
- Masa atomowa H: 1 g/mol.
- Masa molowa NaOH: 23 + 16 + 1 = 40 g/mol.
Proste, prawda? Ważne, żeby dobrze odczytywać masy atomowe z układu okresowego.
Częste błędy i jak ich unikać
Najczęstsze błędy przy rozwiązywaniu zadań z wodorotlenków:
- Nieprawidłowe określanie wartościowości metalu: Zawsze sprawdź grupę w układzie okresowym lub, jeśli to możliwe, odczytaj wartościowość z nazwy związku.
- Błędny zapis wzoru sumarycznego: Pamiętaj o umieszczeniu grupy OH w nawiasie, jeśli metal ma wartościowość większą niż I.
- Nieuwzględnianie wartościowości w równaniach reakcji: Równania muszą być zawsze uzgodnione.
- Pomyłki przy obliczaniu masy molowej: Uważaj na jednostki i dobrze odczytuj masy atomowe z układu okresowego.
Przeciwnicy wodorotlenków?
Możesz usłyszeć, że chemia jest nudna i trudna, a wodorotlenki to tylko kolejna porcja skomplikowanych wzorów do zapamiętania. Ale spójrz na to inaczej! Chemia, a w tym wodorotlenki, to klucz do zrozumienia świata wokół nas. Pozwala tworzyć nowe materiały, leki i technologie. To fascynująca dziedzina, która otwiera wiele drzwi!
Podsumowanie i dalsze kroki
Pamiętaj, że kluczem do sukcesu w chemii jest systematyczna praca i cierpliwość. Nie zrażaj się, jeśli coś nie wyjdzie od razu. Ćwicz, rozwiązuj zadania i pytaj nauczyciela, jeśli masz wątpliwości. Im więcej będziesz ćwiczyć, tym łatwiej będzie Ci rozwiązywać zadania z wodorotlenków. A przede wszystkim - nie bój się chemii! To naprawdę ciekawy i przydatny przedmiot.
Teraz, kiedy znasz już podstawy, spróbuj rozwiązać kilka dodatkowych zadań. Poszukaj ich w podręczniku, zeszycie ćwiczeń albo w Internecie. Sprawdź, czy potrafisz pisać wzory sumaryczne, nazywać wodorotlenki i uzgadniać równania reakcji. Powodzenia!
Jakie są Twoje dalsze plany? Spróbujesz dziś rozwiązać jakieś zadanie z wodorotlenków, czy zaczniesz od jutra?