Wodorotlenki Dobrze Rozpuszczalne W Wodzie

Witaj! Dziś zanurzymy się w fascynujący świat wodorotlenków, a konkretnie tych, które są prawdziwymi pływakami – czyli dobrze rozpuszczalnych w wodzie. Wyobraź sobie, że wodorotlenki to małe cegiełki, a woda to basen. Niektóre z tych cegiełek wchodzą do wody bez wahania i od razu się rozpuszczają, stając się niewidoczne. Inne wolą trzymać się razem na brzegu i wcale nie chcą się rozpuścić. Zastanówmy się, dlaczego tak się dzieje.
Czym są wodorotlenki?
Zanim przejdziemy dalej, ustalmy podstawy. Wodorotlenek to związek chemiczny, który zawiera grupę hydroksylową (OH-). To właśnie ta grupa sprawia, że wodorotlenki reagują z kwasami i wykazują właściwości zasadowe. Myśl o grupie hydroksylowej jak o małym magnesie, który przyciąga do siebie inne cząsteczki.
Wzór ogólny wodorotlenku to MOH, gdzie M to metal. To właśnie rodzaj metalu decyduje o tym, czy dany wodorotlenek będzie dobrze rozpuszczalny w wodzie, czy nie. Wyobraź sobie różne metale jako różne charaktery – jedne są bardziej towarzyskie i chętnie wchodzą w interakcje z wodą, a inne są bardziej samotnikami.
Rozpuszczalność – dlaczego jedne się rozpuszczają, a inne nie?
Rozpuszczalność to nic innego jak zdolność danej substancji do mieszania się z wodą, tworząc jednorodną mieszaninę (roztwór). W przypadku wodorotlenków, rozpuszczalność zależy od siły przyciągania między jonami metalu (M+) i jonami hydroksylowymi (OH-) w strukturze wodorotlenku oraz od tego, jak silnie cząsteczki wody "lubią" otaczać te jony.
Aby lepiej to zobrazować, wyobraź sobie konkurs siłowania. Z jednej strony mamy siły przyciągania między jonami w wodorotlenku (jak silne wiązadło między partnerami w parze). Z drugiej strony mamy siły przyciągania między jonami a cząsteczkami wody (jak kibice dopingujący poszczególnych partnerów w parze). Jeśli kibice (woda) są silniejsi i bardziej entuzjastyczni, rozrywają parę (wodorotlenek) i otaczają każdego z partnerów. Wtedy mówimy, że wodorotlenek się rozpuszcza.
Które wodorotlenki są dobrze rozpuszczalne?
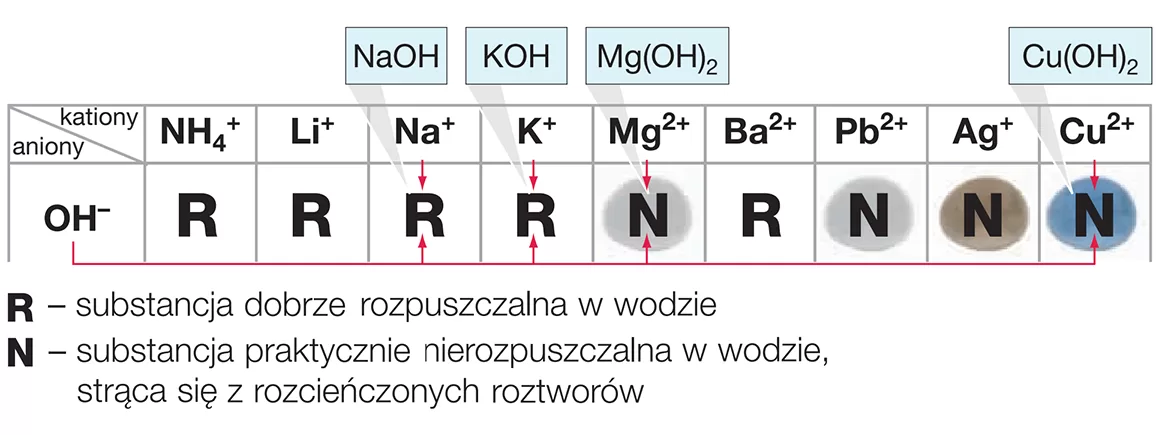
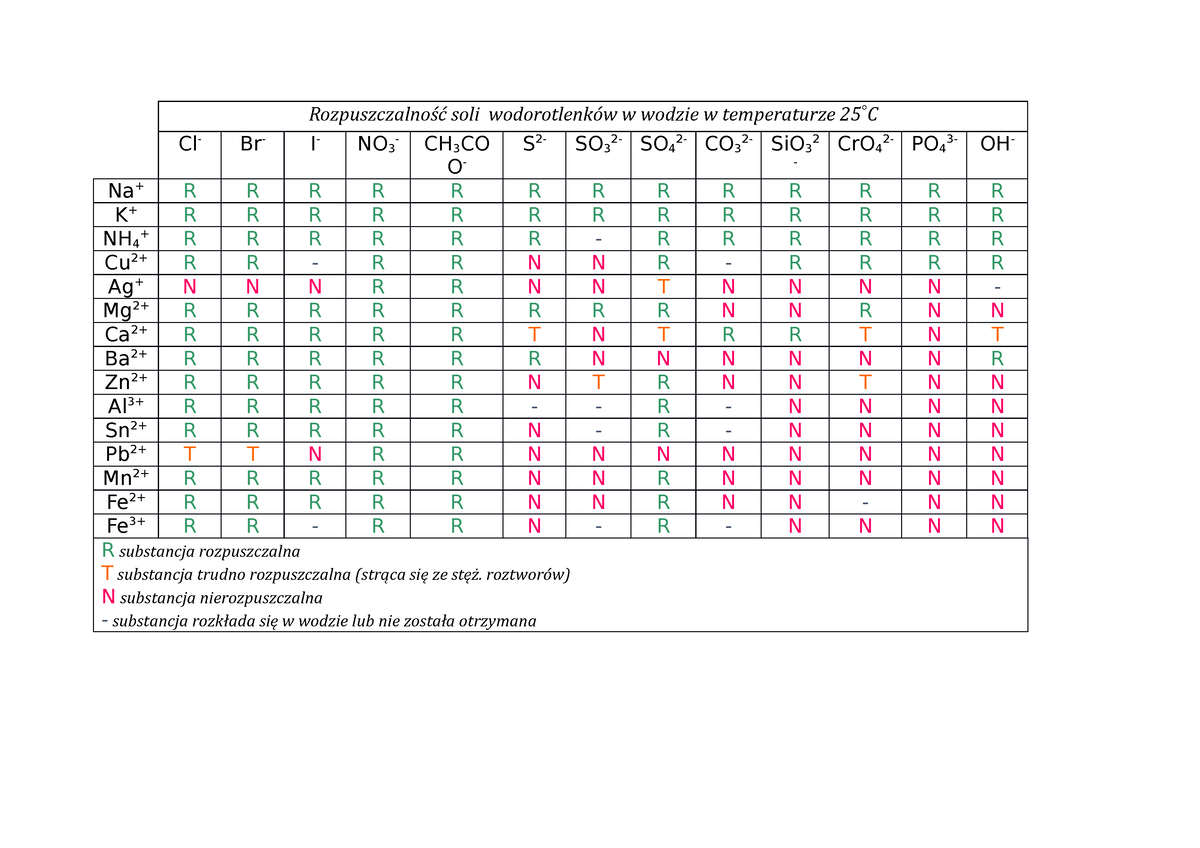
Generalnie, wodorotlenki metali z grupy pierwszej (litowce: lit, sód, potas, rubid, cez i francy) oraz częściowo z grupy drugiej (berylowce: wapń, stront i bar) są dobrze rozpuszczalne w wodzie. Szczególnie dobrze rozpuszczają się wodorotlenki litowców. Można to zapamiętać jako zasadę: "Pierwsza grupa i część drugiej lubią wodę".
Przykłady dobrze rozpuszczalnych wodorotlenków:
- Wodorotlenek sodu (NaOH) – znany również jako soda kaustyczna lub ług sodowy. Używany do produkcji mydła, papieru, w przemyśle chemicznym i do udrażniania rur.
- Wodorotlenek potasu (KOH) – znany również jako potaż żrący. Używany w produkcji mydła potasowego, elektrolitów w akumulatorach alkalicznych i w nawozach.
- Wodorotlenek wapnia (Ca(OH)2) – znany również jako wapno gaszone. Używany w budownictwie (jako składnik zaprawy murarskiej), w rolnictwie do odkwaszania gleby i w procesach oczyszczania wody.
Wodorotlenki pozostałych metali są zazwyczaj słabo rozpuszczalne lub praktycznie nierozpuszczalne w wodzie. Na przykład wodorotlenek żelaza(III) (Fe(OH)3) to rdzawy osad, który powstaje, gdy żelazo koroduje w obecności wody. Nie rozpuszcza się on w wodzie, dlatego widzimy go jako osad.
Dlaczego wodorotlenki litowców są tak dobrze rozpuszczalne?
Odpowiedź leży w wielkości jonów. Litowce mają stosunkowo duże jony o niskim ładunku dodatnim. Oznacza to, że siła przyciągania między jonem metalu a jonem hydroksylowym jest stosunkowo słaba. Z drugiej strony, cząsteczki wody łatwo otaczają te jony i stabilizują je w roztworze. Można to porównać do sytuacji, w której duża, lekka piłka jest łatwiejsza do utrzymania w wodzie niż mała, ciężka kula.
Jak sprawdzić rozpuszczalność wodorotlenku?
Najprostszym sposobem jest sprawdzenie tabeli rozpuszczalności, która znajduje się w każdym podręczniku chemii lub w internecie. Tabela ta pokazuje, które związki są rozpuszczalne (R), trudno rozpuszczalne (Tr) lub nierozpuszczalne (N).
Można również przeprowadzić prosty eksperyment. Wsyp niewielką ilość wodorotlenku do wody i mieszaj. Jeśli wodorotlenek szybko się rozpuści, tworząc klarowny roztwór, to znaczy, że jest dobrze rozpuszczalny. Jeśli natomiast na dnie naczynia pozostanie osad, to wodorotlenek jest słabo rozpuszczalny lub nierozpuszczalny.
Podsumowanie
Podsumowując, rozpuszczalność wodorotlenków w wodzie zależy głównie od rodzaju metalu, który tworzy ten wodorotlenek. Wodorotlenki litowców i częściowo berylowców są dobrze rozpuszczalne, ponieważ mają duże jony o niskim ładunku, co ułatwia otaczanie ich przez cząsteczki wody. Inne wodorotlenki są zazwyczaj słabo rozpuszczalne lub nierozpuszczalne.
Pamiętaj, że zrozumienie rozpuszczalności wodorotlenków jest kluczowe do zrozumienia wielu reakcji chemicznych i procesów przemysłowych. Mam nadzieję, że ten artykuł pomógł Ci w zrozumieniu tego zagadnienia!


+można+otrzymywać+w+reakcjach:+metalu+gr.1+lub+2+z+wodą:.jpg)
+i+wodorotlenek+żelaza(III)+wytrącają+się+w+roztworach+wodnych+w+postaci+osadów%2C+czyli+w+wodzie+się+nie+rozpuszczają..jpg)