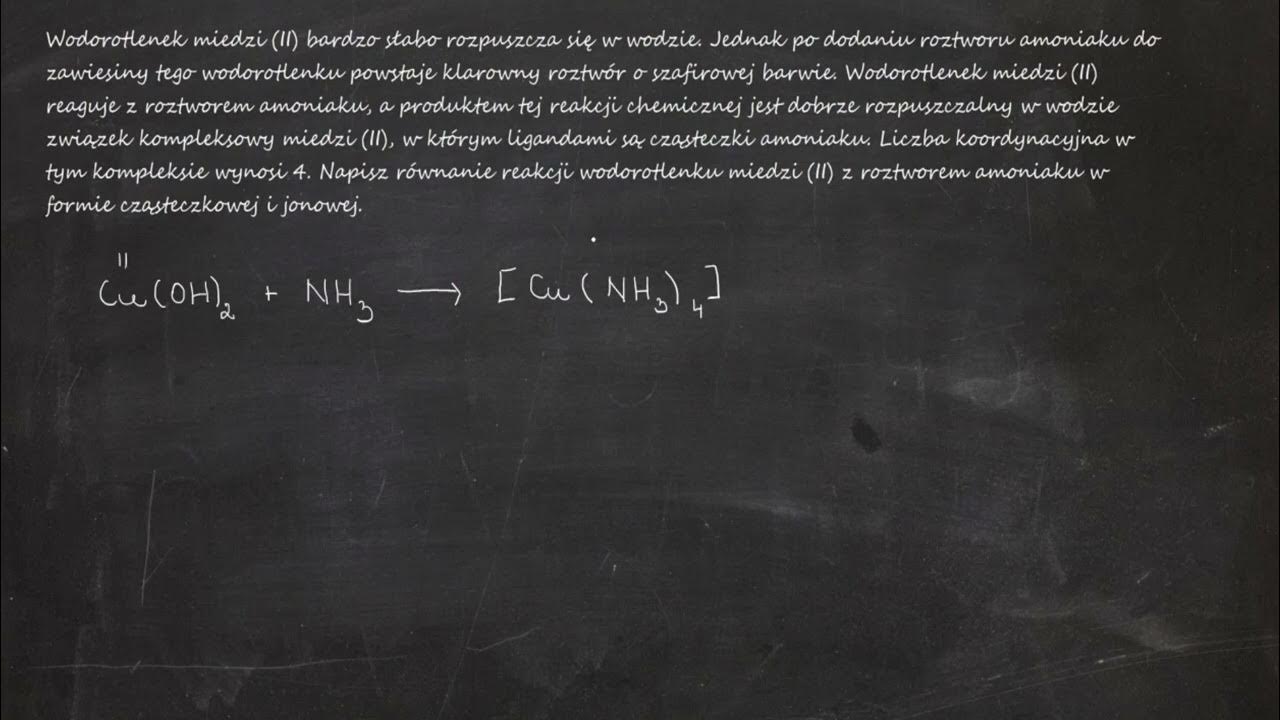Wodorotlenek Miedzi 2 Wzór Sumaryczny

Zastanawiałeś się kiedyś, co kryje się za tajemniczymi nazwami substancji chemicznych, które spotykasz w życiu codziennym, choćby na lekcjach chemii? Jedną z nich jest wodorotlenek miedzi(II). Może brzmi skomplikowanie, ale obiecuję, że spróbujemy go rozgryźć razem, krok po kroku. Zrozumienie wzoru sumarycznego tego związku otworzy Ci drzwi do fascynującego świata chemii nieorganicznej.
Często słyszę od uczniów, że chemia jest trudna i niezrozumiała. Problem leży często w hermetycznym języku. Dlatego postaram się wytłumaczyć wszystko tak prosto, jak to możliwe, unikając zbędnego żargonu. Skupimy się na praktycznym zrozumieniu, które możesz wykorzystać nie tylko na lekcjach, ale i w życiu.
Czym jest wodorotlenek miedzi(II)?
Wodorotlenek miedzi(II) to nieorganiczny związek chemiczny o wzorze sumarycznym Cu(OH)2. To ciało stałe o charakterystycznym niebieskim lub zielononiebieskim kolorze. Jest nierozpuszczalny w wodzie i powstaje w wyniku reakcji roztworu soli miedzi(II) z zasadą, np. wodorotlenkiem sodu lub potasu.
Wyobraź sobie, że masz roztwór siarczanu miedzi(II), który jest niebieski. Dodajesz do niego kroplami roztwór wodorotlenku sodu (czyli popularny "sodowy"). Zauważysz, że zaczyna się wytrącać niebieski osad - to właśnie wodorotlenek miedzi(II). Bardzo często możemy się z nim spotkać podczas eksperymentów chemicznych.
Wzór sumaryczny Cu(OH)2 – co oznacza?
Wzór sumaryczny Cu(OH)2 mówi nam dokładnie, z jakich atomów składa się cząsteczka wodorotlenku miedzi(II) i w jakich proporcjach te atomy występują. Przyjrzyjmy się mu bliżej:
- Cu: Symbol chemiczny miedzi. Oznacza, że w cząsteczce znajduje się jeden atom miedzi.
- (OH): Grupa wodorotlenowa (hydroksylowa). Składa się z atomu tlenu (O) i atomu wodoru (H).
- 2: Indeks dolny umieszczony za nawiasem, który wskazuje, że w cząsteczce znajdują się dwie grupy wodorotlenowe.
Czyli, wodorotlenek miedzi(II) składa się z jednego atomu miedzi, dwóch atomów tlenu i dwóch atomów wodoru. Łącznie mamy więc pięć atomów w jednej cząsteczce.
Jak powstaje wodorotlenek miedzi(II)?
Tak jak wspomniałem wcześniej, wodorotlenek miedzi(II) powstaje w reakcji soli miedzi(II) z mocną zasadą. Możemy to zapisać jako równanie reakcji:
CuSO4 (aq) + 2 NaOH (aq) → Cu(OH)2 (s) + Na2SO4 (aq)
Gdzie:
- CuSO4 (aq) - roztwór siarczanu miedzi(II)
- NaOH (aq) - roztwór wodorotlenku sodu
- Cu(OH)2 (s) - wodorotlenek miedzi(II) (osad)
- Na2SO4 (aq) - roztwór siarczanu sodu
Równanie to pokazuje, że siarczan miedzi(II) reaguje z wodorotlenkiem sodu, w wyniku czego powstaje nierozpuszczalny wodorotlenek miedzi(II), który wytrąca się w postaci osadu, oraz rozpuszczalny siarczan sodu.
Właściwości wodorotlenku miedzi(II)
Poznanie właściwości wodorotlenku miedzi(II) pozwala lepiej zrozumieć jego zastosowanie i rolę w różnych procesach chemicznych. Najważniejsze właściwości to:
- Wygląd: Niebieski lub zielononiebieski osad.
- Rozpuszczalność: Praktycznie nierozpuszczalny w wodzie.
- Stabilność termiczna: Pod wpływem wysokiej temperatury rozkłada się na tlenek miedzi(II) (CuO) i wodę (H2O).
- Reakcje chemiczne: Reaguje z kwasami, tworząc sole miedzi(II). Rozpuszcza się w roztworze amoniaku, tworząc intensywnie niebieski kompleksowy jon [Cu(NH3)4]2+.
Reakcja z kwasami jest szczególnie ważna. Na przykład, jeśli dodamy kwas solny (HCl) do wodorotlenku miedzi(II), zaobserwujemy rozpuszczenie się osadu i powstanie roztworu chlorku miedzi(II), który ma zielony kolor.
Zastosowanie wodorotlenku miedzi(II)
Wodorotlenek miedzi(II) ma szerokie zastosowanie w różnych dziedzinach. Oto kilka przykładów:
- Fungicydy: Stosowany jako środek grzybobójczy w rolnictwie i ogrodnictwie, np. do zwalczania zarazy ziemniaczanej.
- Produkcja pigmentów: Używany jako pigment w farbach i ceramice.
- Katalizator: W niektórych reakcjach chemicznych pełni rolę katalizatora.
- Synteza innych związków miedzi: Jest substratem w syntezie innych związków miedzi, np. tlenku miedzi(II).
- Reagent w chemii analitycznej: Wykorzystywany do wykrywania obecności niektórych związków organicznych.
Wykorzystanie wodorotlenku miedzi(II) jako fungicydu wynika z jego toksyczności dla grzybów. Spryskiwanie roślin roztworem zawierającym ten związek chroni je przed infekcjami.
Bezpieczeństwo i postępowanie z wodorotlenkiem miedzi(II)
Chociaż wodorotlenek miedzi(II) ma wiele zastosowań, należy pamiętać o zachowaniu ostrożności podczas pracy z nim. Jest to związek drażniący, który może powodować podrażnienia skóry i oczu. W przypadku połknięcia może wywołać nudności i wymioty.
Zawsze należy przestrzegać następujących zasad:
- Używać rękawic ochronnych i okularów.
- Unikać wdychania pyłu.
- Przechowywać w szczelnie zamkniętych pojemnikach, w suchym i chłodnym miejscu.
- W razie kontaktu ze skórą lub oczami, przemyć obficie wodą.
Jeżeli planujesz przeprowadzać eksperymenty z wodorotlenkiem miedzi(II), upewnij się, że masz odpowiednie wyposażenie ochronne i przeprowadzasz je w dobrze wentylowanym pomieszczeniu.
Podsumowanie – wzór sumaryczny w pigułce
Wodorotlenek miedzi(II), o wzorze sumarycznym Cu(OH)2, to ważny związek chemiczny o wielu zastosowaniach. Jego struktura i właściwości determinują jego rolę w przemyśle, rolnictwie i laboratoriach. Mam nadzieję, że ten artykuł pomógł Ci zrozumieć podstawy dotyczące tej substancji.
Pamiętaj, że kluczem do zrozumienia chemii jest powolne i systematyczne przyswajanie wiedzy. Nie zrażaj się trudnymi nazwami i wzorami. Z czasem, przy odrobinie wysiłku i ciekawości, wszystko stanie się jasne. A jeśli masz pytania, zawsze możesz poszukać odpowiedzi w wiarygodnych źródłach lub zapytać nauczyciela.
Dalsza nauka – gdzie szukać informacji?
Jeśli chcesz pogłębić swoją wiedzę na temat wodorotlenku miedzi(II) i innych związków chemicznych, polecam następujące źródła:
- Podręczniki do chemii.
- Encyklopedie chemiczne.
- Strony internetowe poświęcone chemii, np. Wikipedia (zawsze weryfikuj informacje).
- Artykuły naukowe (jeśli interesuje Cię bardziej zaawansowana wiedza).
Chemia to fascynująca dziedzina nauki, która pozwala nam lepiej zrozumieć otaczający nas świat. Nie bój się eksperymentować i zadawać pytań. Powodzenia w dalszej nauce!