Woda Jest Aktywnym Zwiazkiem Nieorganicznym Ktorego Polarne Czasteczki

Drodzy Uczniowie,
Wasze pytanie o wodę jako aktywny związek nieorganiczny o polarnych cząsteczkach jest bardzo istotne. Postaram się przedstawić Wam to zagadnienie w sposób wyczerpujący i szczegółowy, bazując na najnowszej wiedzy z zakresu chemii i fizyki.
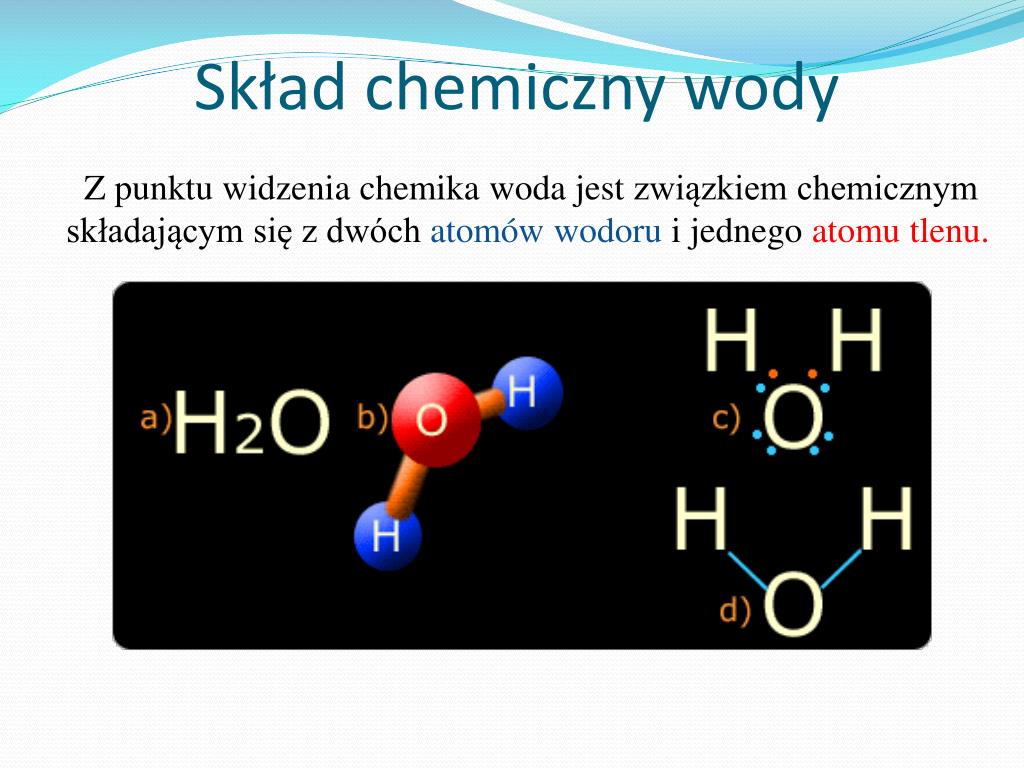
Woda (H₂O) jest fundamentalnym związkiem nieorganicznym, absolutnie niezbędnym dla życia na Ziemi. Jej unikalne właściwości wynikają wprost z jej budowy molekularnej i, co kluczowe, z polarności jej cząsteczek. Aby zrozumieć tę polarność, musimy zagłębić się w strukturę atomową i konfigurację elektronową. Atom tlenu w cząsteczce wody łączy się z dwoma atomami wodoru za pomocą wiązań kowalencyjnych. Tlen jest bardziej elektroujemny niż wodór, co oznacza, że silniej przyciąga elektrony tworzące wiązanie. W efekcie, elektrony spędzają więcej czasu w pobliżu atomu tlenu, tworząc na nim częściowy ładunek ujemny (δ-), a na atomach wodoru częściowe ładunki dodatnie (δ+). Ta nierównomierność w rozkładzie ładunku elektrycznego powoduje powstanie dipola elektrycznego w cząsteczce wody – mamy więc cząsteczkę polarną.
Ta polarność ma dalekosiężne konsekwencje dla właściwości fizycznych i chemicznych wody, a także dla jej roli w procesach biologicznych.
Wpływ Polarności na Właściwości Wody
Polarność cząsteczek wody prowadzi do powstawania wiązań wodorowych między nimi. Wiązanie wodorowe powstaje, gdy atom wodoru z częściowym ładunkiem dodatnim w jednej cząsteczce wody oddziałuje elektrostatycznie z atomem tlenu z częściowym ładunkiem ujemnym w innej cząsteczce. Choć wiązania wodorowe są słabsze od wiązań kowalencyjnych, to ich ogromna ilość w wodzie sprawia, że mają znaczący wpływ na jej właściwości.
Po pierwsze, wiązania wodorowe powodują, że woda ma stosunkowo wysoką temperaturę wrzenia i topnienia w porównaniu z innymi związkami o podobnej masie cząsteczkowej. Większa energia jest potrzebna do rozerwania tych wiązań, aby umożliwić przejście wody w stan gazowy lub stopiony.
Po drugie, woda ma wysokie ciepło właściwe. Oznacza to, że potrzeba dużej ilości energii, aby podnieść temperaturę wody o 1 stopień Celsjusza. Jest to związane z tym, że większość dostarczonej energii jest zużywana na rozerwanie wiązań wodorowych, a tylko niewielka część na zwiększenie energii kinetycznej cząsteczek. Dzięki temu woda odgrywa ważną rolę w termoregulacji organizmów i stabilizacji klimatu.
Po trzecie, woda ma wysokie ciepło parowania. Duża ilość energii jest potrzebna do przejścia wody w stan pary, co sprawia, że parowanie wody jest skutecznym mechanizmem chłodzenia.
Po czwarte, woda ma duże napięcie powierzchniowe. Cząsteczki wody na powierzchni są silniej przyciągane do siebie niż do cząsteczek powietrza, co powoduje powstawanie napięcia powierzchniowego. To napięcie pozwala małym owadom chodzić po powierzchni wody.
Po piąte, lód jest mniej gęsty niż woda w stanie ciekłym. Jest to anomalia, która jest kluczowa dla życia w wodzie. Kiedy woda zamarza, tworzy strukturę krystaliczną, w której cząsteczki wody są oddalone od siebie bardziej niż w stanie ciekłym. Dlatego lód unosi się na powierzchni wody, izolując wodę pod spodem i umożliwiając przetrwanie organizmom wodnym w zimie.
Po szóste, woda jest doskonałym rozpuszczalnikiem dla wielu substancji polarnych i jonowych. Jony i cząsteczki polarne są otaczane przez cząsteczki wody, co stabilizuje je w roztworze. Zdolność wody do rozpuszczania wielu substancji jest niezbędna dla transportu składników odżywczych i usuwania odpadów w organizmach, a także dla procesów chemicznych zachodzących w środowisku.
Aktywność Chemiczna Wody
Woda nie jest tylko pasywnym rozpuszczalnikiem, ale również aktywnym uczestnikiem wielu reakcji chemicznych. Ze względu na swoją polarność i obecność atomów wodoru i tlenu, woda może pełnić rolę zarówno kwasu, jak i zasady (jest amfoteryczna).
Woda ulega autodysocjacji, czyli procesowi, w którym cząsteczka wody oddaje proton (H⁺) innej cząsteczce wody, tworząc jon hydroniowy (H₃O⁺) i jon wodorotlenkowy (OH⁻). Równowaga tej reakcji jest przesunięta w stronę wody niezdysocjowanej, ale obecność jonów hydroniowych i wodorotlenkowych jest kluczowa dla wielu reakcji kwasowo-zasadowych.
Woda bierze udział w reakcjach hydrolizy, w których wiązanie chemiczne jest rozrywane z udziałem cząsteczki wody. Hydroliza jest ważnym procesem w trawieniu, gdzie złożone cząsteczki, takie jak białka, węglowodany i tłuszcze, są rozkładane na mniejsze jednostki.
Woda jest również produktem wielu reakcji, takich jak reakcje kondensacji, w których dwie cząsteczki łączą się ze sobą, uwalniając cząsteczkę wody. Reakcje kondensacji są ważne w syntezie polimerów, takich jak białka i kwasy nukleinowe.
Ponadto, woda odgrywa kluczową rolę w fotosyntezie, procesie, w którym rośliny wykorzystują energię słoneczną do przekształcania dwutlenku węgla i wody w glukozę i tlen. Woda jest źródłem elektronów potrzebnych do redukcji dwutlenku węgla.
Mam nadzieję, że ta szczegółowa odpowiedź rzuca światło na rolę wody jako aktywnego związku nieorganicznego o polarnych cząsteczkach. Pamiętajcie, że zrozumienie właściwości wody jest kluczowe dla zrozumienia wielu procesów zachodzących w przyrodzie i w naszym organizmie. Jeśli macie dodatkowe pytania, jestem do Waszej dyspozycji.