Woda I Roztwory Wodne Sprawdzian

Czy kiedykolwiek zastanawiałeś się, co tak naprawdę kryje się w szklance wody, którą pijesz każdego dnia? Albo jak to możliwe, że sól rozpuszcza się w wodzie, tworząc roztwór? Jeśli jesteś uczniem szkoły podstawowej lub gimnazjum przygotowującym się do sprawdzianu z chemii, dotyczącego wody i roztworów wodnych, to ten artykuł jest dla Ciebie. Razem zgłębimy tajniki wody, rozpuszczania i roztworów, abyś mógł z pewnością siebie napisać sprawdzian!
Woda – niezwykła substancja
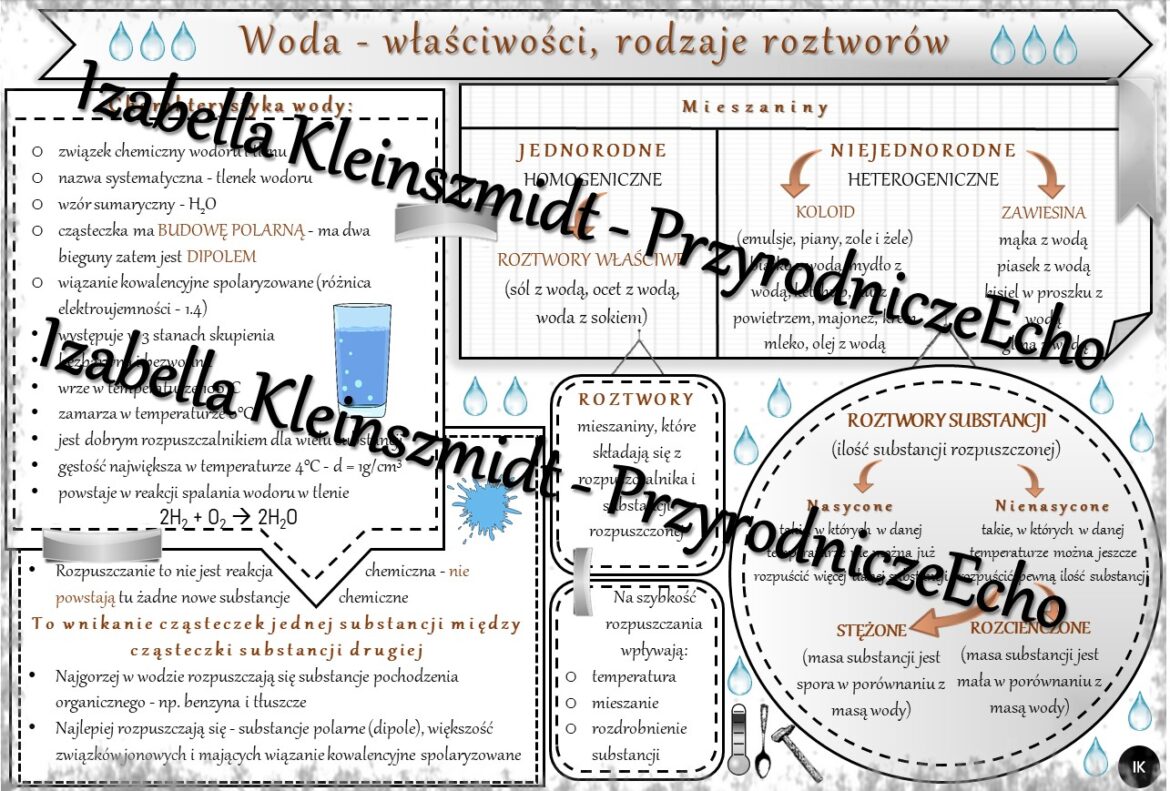
Woda (H2O) to związek chemiczny, bez którego życie na Ziemi byłoby niemożliwe. Jej unikalne właściwości wynikają z jej budowy – cząsteczka wody jest polarna, co oznacza, że ma jeden koniec o ładunku dodatnim (wodór) i jeden o ładunku ujemnym (tlen). To właśnie polarność odpowiada za tak wiele niezwykłych cech wody.
Dlaczego woda jest dobrym rozpuszczalnikiem?
Dzięki swojej polarności, woda jest doskonałym rozpuszczalnikiem dla wielu substancji, szczególnie tych, które również są polarne (np. sól). Dzieje się tak, ponieważ cząsteczki wody przyciągają się do cząsteczek substancji rozpuszczanej, "oddzielając" je od siebie i otaczając. Ten proces nazywamy hydratacją, gdy rozpuszczalnikiem jest woda.
Zastanówmy się nad solą kuchenną (NaCl). Kiedy wrzucimy ją do wody, cząsteczki wody będą przyciągać jony sodu (Na+) i jony chlorkowe (Cl-), oddzielając je od kryształu soli. Każdy jon zostanie otoczony przez cząsteczki wody, uniemożliwiając im ponowne połączenie się w kryształ. W ten sposób sól się rozpuszcza.
Inne ważne właściwości wody
- Wysokie ciepło właściwe: Woda potrzebuje dużo energii, aby zmienić swoją temperaturę. Dzięki temu oceany i jeziora działają jak ogromne regulatory temperatury, stabilizując klimat.
- Wysokie ciepło parowania: Parowanie wody wymaga również dużej ilości energii, co pozwala nam się ochładzać podczas pocenia się.
- Napięcie powierzchniowe: Cząsteczki wody silnie przyciągają się do siebie, tworząc "skórkę" na powierzchni wody. To napięcie powierzchniowe pozwala owadom chodzić po wodzie.
- Gęstość lodu: Lód jest mniej gęsty niż woda, dlatego pływa na jej powierzchni. Gdyby było inaczej, jeziora i rzeki zamarzałyby od dna, co byłoby zabójcze dla życia wodnego.
Roztwory wodne – mieszaniny o niezwykłych właściwościach
Roztwór to jednorodna mieszanina dwóch lub więcej substancji. Składa się z rozpuszczalnika (substancji, która rozpuszcza inne substancje) i substancji rozpuszczanej (substancji, która ulega rozpuszczeniu). W roztworach wodnych rozpuszczalnikiem jest zawsze woda.
Rodzaje roztworów ze względu na wielkość cząstek substancji rozproszonej:
- Roztwory właściwe: Cząsteczki substancji rozpuszczonej są bardzo małe (jony, cząsteczki). Roztwór jest klarowny i jednorodny, np. roztwór soli w wodzie.
- Koloidy: Cząsteczki substancji rozproszonej są większe niż w roztworach właściwych, ale wciąż na tyle małe, że nie opadają na dno. Koloidy mogą być mętne, np. mleko.
- Zawiesiny: Cząsteczki substancji rozproszonej są na tyle duże, że po pewnym czasie opadają na dno. Zawiesiny są mętne i nieprzezroczyste, np. woda z piaskiem.
Stężenie roztworu – ile substancji w roztworze?
Stężenie roztworu określa, ile substancji rozpuszczonej znajduje się w danej ilości roztworu. Istnieje wiele sposobów wyrażania stężenia, ale na sprawdzianie najczęściej spotkasz się ze stężeniem procentowym (%).
Stężenie procentowe (Cp) określa, ile gramów substancji rozpuszczonej znajduje się w 100 gramach roztworu. Obliczamy je ze wzoru:
Cp = (masa substancji / masa roztworu) * 100%
Przykład: Jeśli rozpuścimy 20 gramów soli w 80 gramach wody, to masa roztworu wynosi 100 gramów (20g + 80g). Stężenie procentowe tego roztworu wynosi:
Cp = (20g / 100g) * 100% = 20%
Oznacza to, że w 100 gramach roztworu znajduje się 20 gramów soli.
Rozpuszczalność – ile można rozpuścić?
Rozpuszczalność to maksymalna ilość substancji, którą można rozpuścić w danej ilości rozpuszczalnika (zazwyczaj 100g) w danej temperaturze, aby otrzymać roztwór nasycony. Roztwór nasycony to taki roztwór, w którym nie można już rozpuścić więcej danej substancji w danej temperaturze.
Rozpuszczalność zależy od:
- Rodzaju substancji rozpuszczanej i rozpuszczalnika: Niektóre substancje rozpuszczają się w wodzie lepiej niż inne.
- Temperatury: Zazwyczaj rozpuszczalność ciał stałych rośnie wraz ze wzrostem temperatury, a rozpuszczalność gazów maleje.
- Ciśnienia: Ciśnienie ma istotny wpływ na rozpuszczalność gazów w cieczach.
Czynniki wpływające na szybkość rozpuszczania
Na szybkość rozpuszczania wpływają:
- Rozdrobnienie substancji: Im bardziej rozdrobniona substancja, tym szybciej się rozpuszcza (np. cukier puder rozpuszcza się szybciej niż kryształ cukru).
- Mieszanie: Mieszanie przyspiesza rozpuszczanie, ponieważ pomaga cząsteczkom rozpuszczalnika dotrzeć do cząsteczek substancji rozpuszczanej.
- Temperatura: Zazwyczaj podwyższenie temperatury przyspiesza rozpuszczanie.
Przykłady zastosowań roztworów wodnych w życiu codziennym
Roztwory wodne otaczają nas zewsząd. Oto kilka przykładów:
- Soki i napoje: To roztwory wodne cukrów, kwasów i aromatów.
- Płyny do mycia naczyń i prania: Zawierają substancje powierzchniowo czynne, które ułatwiają usuwanie brudu i tłuszczu.
- Leki: Wiele leków występuje w postaci roztworów wodnych, co ułatwia ich wchłanianie przez organizm.
- Krew: To złożony roztwór wodny zawierający wiele różnych substancji, m.in. białka, sole mineralne i gazy.
- Woda morska: To roztwór wodny zawierający różne sole mineralne, głównie chlorek sodu (sól kuchenną).
Jak przygotować się do sprawdzianu?
- Przejrzyj notatki z lekcji: Upewnij się, że rozumiesz wszystkie omawiane zagadnienia.
- Rozwiąż zadania: Ćwiczenie czyni mistrza! Im więcej zadań rozwiążesz, tym lepiej zrozumiesz materiał.
- Skorzystaj z podręcznika: Przeczytaj rozdziały dotyczące wody i roztworów wodnych.
- Zadawaj pytania: Jeśli masz jakieś wątpliwości, nie bój się zapytać nauczyciela lub kolegów z klasy.
- Odpocznij: Nie ucz się na ostatnią chwilę! Wyspany umysł lepiej przyswaja wiedzę.
Pamiętaj, że zrozumienie, a nie tylko zapamiętanie, jest kluczem do sukcesu na sprawdzianie. Staraj się łączyć teorię z praktyką, szukaj przykładów w życiu codziennym i baw się nauką. Powodzenia!