Woda I Roztwory Wodne Klasa 7
Witaj w świecie wody i roztworów wodnych! Jeśli jesteś w siódmej klasie, to prawdopodobnie właśnie zaczynasz przygodę z tym fascynującym tematem. Może wydawać się skomplikowany, ale obiecuję, że rozłożymy go na proste kawałki. Pomyśl o tym tak: woda to podstawa życia, a roztwory wodne są wszędzie wokół nas – w tym, co pijemy, jemy, a nawet w powietrzu, którym oddychamy. Zrozumienie tych zagadnień pozwoli Ci lepiej rozumieć świat i rozwiązywać codzienne problemy.
Dlaczego Woda Jest Taka Wyjątkowa?
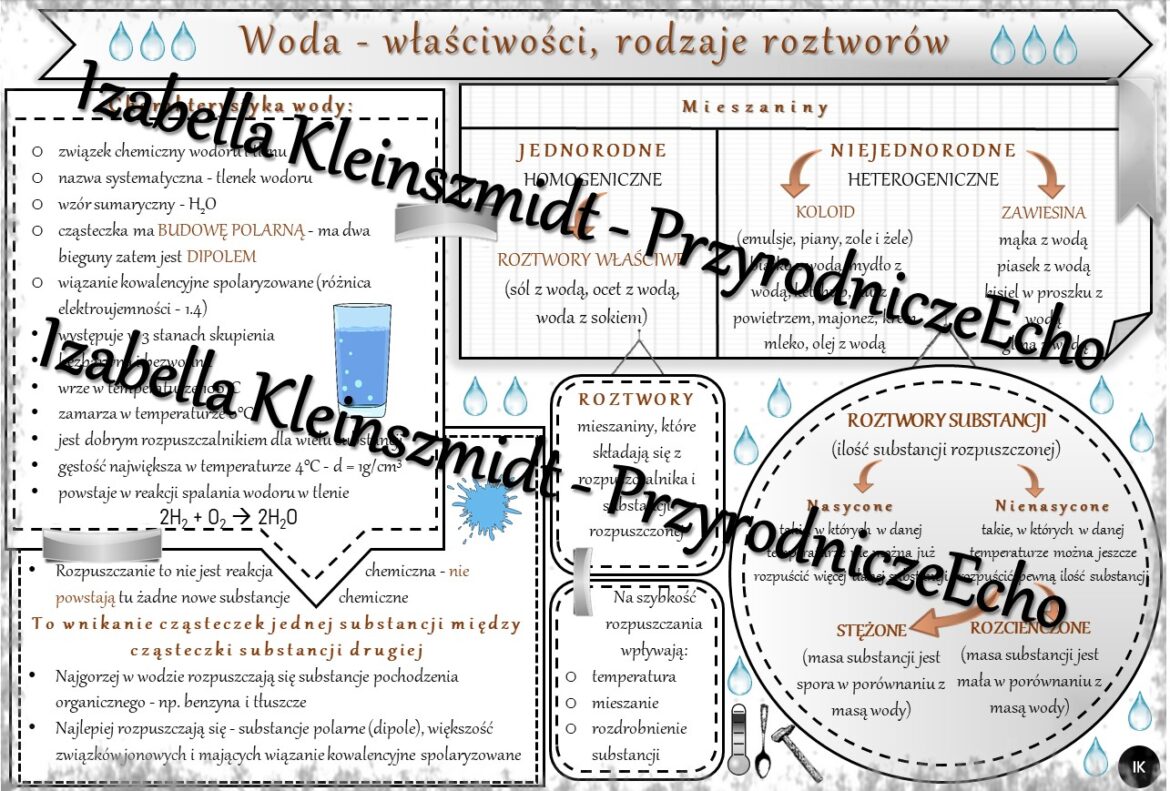
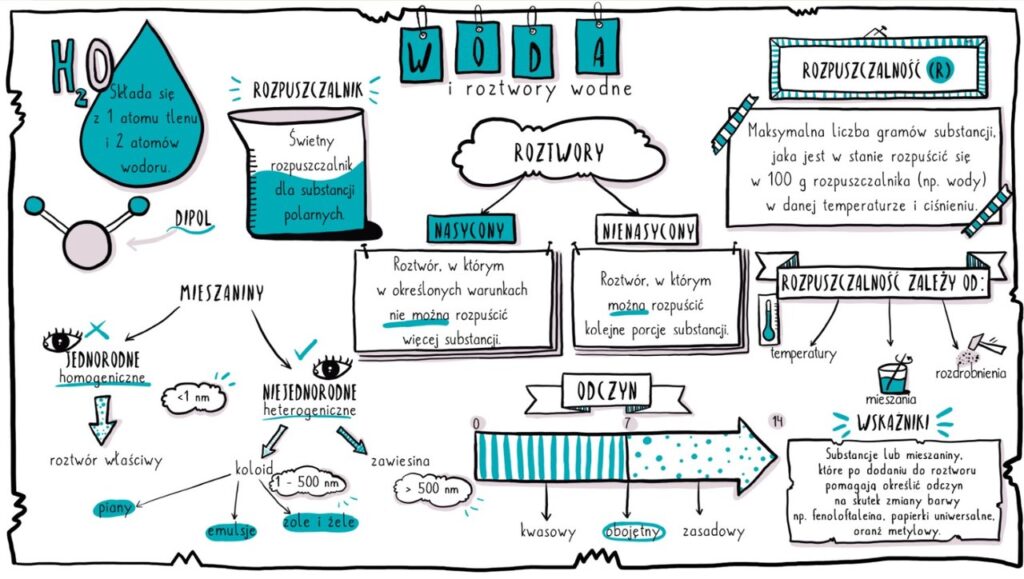
Woda, czyli H2O, to związek chemiczny składający się z dwóch atomów wodoru i jednego atomu tlenu. To, co czyni ją wyjątkową, to jej polarna budowa. Co to znaczy?
Wyobraź sobie, że w atomie tlenu „ciągnie” on silniej elektrony niż atom wodoru. To powoduje, że tlen ma delikatnie ujemny ładunek, a wodór delikatnie dodatni. Jak magnes!
- Polarność: To właśnie ta polarność sprawia, że cząsteczki wody „przyciągają się” do siebie nawzajem, tworząc wiązania wodorowe.
- Napięcie powierzchniowe: Dzięki tym wiązaniom woda ma wysokie napięcie powierzchniowe. Dlatego małe owady mogą chodzić po powierzchni wody!
- Rozpuszczalnik: Woda jest nazywana uniwersalnym rozpuszczalnikiem. Dlaczego? Bo potrafi rozpuszczać wiele substancji, szczególnie tych polarnych.
- Anomalia wody: Woda ma największą gęstość w temperaturze 4°C. Dlatego lód pływa po powierzchni wody – gdyby było inaczej, życie w zbiornikach wodnych w zimie byłoby niemożliwe!
Woda a Życie
Pomyśl o swoim ciele – około 60-70% to woda! Woda jest niezbędna do:
- Transportu składników odżywczych i tlenu do komórek.
- Regulacji temperatury ciała (pocenie się!).
- Usuwania produktów przemiany materii.
- Przebiegu większości reakcji chemicznych w organizmie.
Czym Są Roztwory Wodne?
Roztwór to mieszanina jednorodna dwóch lub więcej substancji. W przypadku roztworów wodnych, woda pełni rolę rozpuszczalnika, a substancja rozpuszczana – substancji rozpuszczonej.
Przykłady roztworów wodnych, z którymi masz do czynienia na co dzień:
- Słodka herbata (woda + cukier + herbata)
- Sól fizjologiczna (woda + sól)
- Woda z mydłem
- Woda mineralna (woda + sole mineralne)
Proces Rozpuszczania
Co się dzieje, gdy wrzucasz cukier do wody? Cząsteczki wody otaczają kryształki cukru i rozrywają wiązania między nimi. Cząsteczki cukru rozpraszają się w całej objętości wody, tworząc roztwór. To jest możliwe, bo cząsteczki cukru są polarne – tak jak woda!
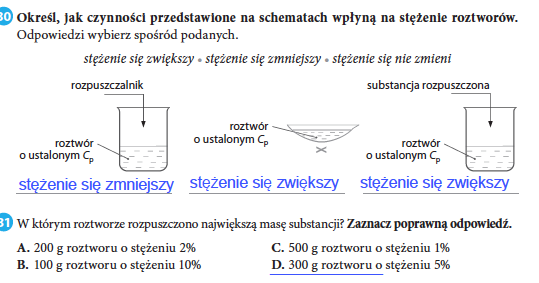
Stężenie Roztworu
Stężenie roztworu określa, ile substancji jest rozpuszczone w danej ilości rozpuszczalnika (wody). Można je wyrazić na różne sposoby, ale na początek najważniejsze są:
- Roztwór rozcieńczony: Zawiera małą ilość substancji rozpuszczonej.
- Roztwór stężony: Zawiera dużą ilość substancji rozpuszczonej.
Ważne: Roztwór może być nasycony, czyli taki, w którym nie można już rozpuścić więcej substancji w danej temperaturze. Jeśli spróbujesz dodać więcej cukru do herbaty, a cukier zacznie osiadać na dnie, to znaczy, że masz roztwór nasycony.
Czynniki Wpływające na Rozpuszczalność
Na to, jak dobrze coś rozpuszcza się w wodzie, wpływa kilka czynników:
- Temperatura: Zazwyczaj, im wyższa temperatura, tym więcej substancji można rozpuścić (szczególnie w przypadku ciał stałych). Wyjątkiem są gazy – ich rozpuszczalność maleje wraz ze wzrostem temperatury (dlatego napoje gazowane "wietrzeją").
- Ciśnienie: Ma duży wpływ na rozpuszczalność gazów. Im wyższe ciśnienie, tym więcej gazu rozpuści się w wodzie (dlatego napoje gazowane są butelkowane pod ciśnieniem).
- Rodzaj substancji rozpuszczonej i rozpuszczalnika: Zasada "podobne rozpuszcza się w podobnym" – substancje polarne dobrze rozpuszczają się w rozpuszczalnikach polarnych (np. woda), a substancje niepolarne – w rozpuszczalnikach niepolarnych (np. oleje).
Rozdzielanie Mieszanin
Jeśli masz roztwór wodny, czasem chcesz oddzielić od siebie substancję rozpuszczoną i rozpuszczalnik. Istnieje kilka metod:
- Odparowanie: Podgrzewasz roztwór, aż woda wyparuje, a na dnie naczynia pozostaje substancja rozpuszczona (np. sól).
- Dekantacja: Ostrożnie zlewasz ciecz znad osadu (np. oddzielanie piasku od wody).
- Filtracja: Przelewasz mieszaninę przez filtr, który zatrzymuje cząstki stałe, przepuszczając ciecz (np. oddzielanie fusów od kawy).
- Destylacja: Wykorzystujesz różnicę w temperaturach wrzenia substancji. Podgrzewasz mieszaninę, a para cieczy o niższej temperaturze wrzenia jest skraplana i zbierana oddzielnie (np. oddzielanie wody od alkoholu).
Woda i Roztwory Wodne w Życiu Codziennym
Woda i roztwory wodne są wszędzie wokół nas. Bez nich nie moglibyśmy żyć! Przykłady:
- Gotowanie: Rozpuszczanie soli, cukru, przypraw w wodzie.
- Higiena osobista: Używanie mydła, szamponu (roztwory wodne).
- Pranie: Używanie proszku do prania (roztwór wodny).
- Nawadnianie roślin: Dostarczanie roślinom wody i składników odżywczych.
- Produkcja napojów: Soki, napoje gazowane, herbata, kawa – wszystko to roztwory wodne.
Wpływ Zanieczyszczeń Wody
Niestety, woda może być zanieczyszczona różnymi substancjami, takimi jak:
- Ścieki komunalne: Zawierają bakterie, wirusy, detergenty, fosforany.
- Ścieki przemysłowe: Zawierają metale ciężkie, substancje toksyczne.
- Nawozy sztuczne i pestycydy: Zanieczyszczają wody gruntowe i powierzchniowe.
- Odpady: Plastik, szkło, papier – zanieczyszczają oceany i rzeki.
Zanieczyszczenie wody ma poważne konsekwencje dla zdrowia ludzi, zwierząt i środowiska. Dlatego tak ważne jest dbanie o czystość wody i racjonalne gospodarowanie zasobami wodnymi.
Podsumowanie i Wyzwania
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć podstawy dotyczące wody i roztworów wodnych. Pamiętaj, że to tylko początek Twojej naukowej przygody! Zachęcam Cię do dalszego zgłębiania tego fascynującego tematu. Zrozumienie roli wody w naszym życiu i w środowisku jest kluczowe dla przyszłości naszej planety.
Wiele osób uważa, że problem zanieczyszczenia wody jest zbyt duży, aby jedna osoba mogła coś zmienić. Jednak każdy mały krok, taki jak oszczędzanie wody, segregacja śmieci czy unikanie stosowania szkodliwych chemikaliów, ma znaczenie.
Pamiętaj, że woda to życie. Dbajmy o nią!
Teraz, gdy wiesz już tak dużo o wodzie i roztworach wodnych, zastanów się: Co Ty możesz zrobić, żeby chronić zasoby wodne w Twojej okolicy?