Właściwości I Budowa Materii Sprawdzian Klasa 7 Pdf

Hej uczniowie! Zastanawialiście się kiedyś, z czego właściwie zbudowany jest świat dookoła nas? Odpowiedź kryje się w zrozumieniu właściwości i budowy materii. Dziś postaramy się to zrozumieć w prosty i przystępny sposób, tak abyście byli gotowi na sprawdzian z tego tematu w 7 klasie! Opowiemy o tym, co to jest materia, z czego się składa i jakie ma właściwości. Gotowi? Zaczynamy!
Zacznijmy od podstaw:
Co to jest materia?
Materia to wszystko, co ma masę i zajmuje przestrzeń. Inaczej mówiąc, wszystko, co możemy zobaczyć, dotknąć, powąchać, a nawet czego nie możemy zobaczyć gołym okiem, ale możemy zmierzyć jego masę, jest materią. To twój stół, twoja książka, powietrze, którym oddychasz, a nawet ty sam!
Z czego składa się materia?
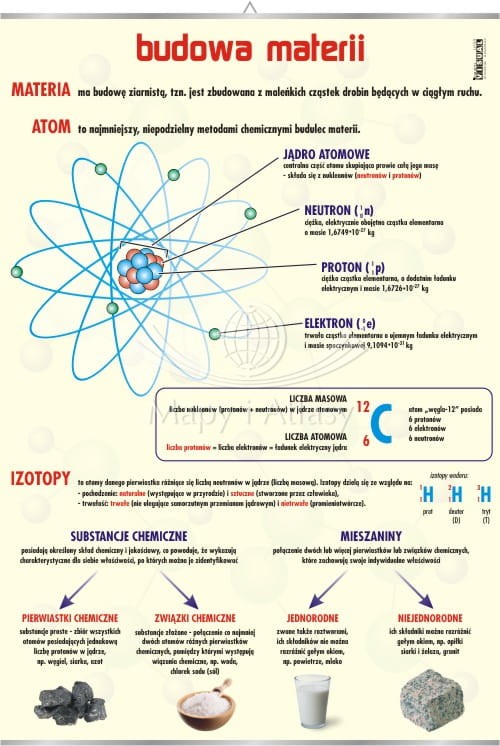
Materia składa się z bardzo małych cząstek, które nazywamy atomami. Wyobraź sobie, że masz kawałek kredy. Możesz go pokruszyć na mniejsze kawałki. A te mniejsze kawałki na jeszcze mniejsze. Gdybyś mógł tak robić w nieskończoność (czego oczywiście nie możesz fizycznie), w końcu dotarłbyś do atomów, które tworzą kredę (czyli głównie wapń, węgiel i tlen).
Atom to podstawowy element materii, który zachowuje właściwości danego pierwiastka. Jest jak cegiełka, z której buduje się cały świat.
Ale to nie wszystko! Atomy same też są zbudowane z jeszcze mniejszych cząstek:
- Protony: Posiadają ładunek dodatni (+) i znajdują się w jądrze atomu.
- Neutrony: Nie posiadają ładunku (są neutralne) i również znajdują się w jądrze atomu.
- Elektrony: Posiadają ładunek ujemny (-) i krążą wokół jądra atomu. Wyobraź sobie elektrony krążące wokół jądra jak planety krążące wokół Słońca.
Liczba protonów w jądrze atomu decyduje o tym, jaki to pierwiastek. Na przykład, atom z jednym protonem to wodór, atom z sześcioma protonami to węgiel, a atom z ośmioma protonami to tlen.
Pierwiastki i Związki Chemiczne
Pierwiastek to substancja składająca się z atomów tego samego rodzaju. Mamy ich sporo – ponad 100 – i są one ułożone w układ okresowy pierwiastków. Przykłady pierwiastków to: żelazo (Fe), miedź (Cu), złoto (Au), tlen (O), wodór (H).
Związek chemiczny to substancja, która powstaje, gdy co najmniej dwa różne pierwiastki łączą się ze sobą w określonych proporcjach. Na przykład: woda (H₂O) to związek chemiczny, w którym dwa atomy wodoru łączą się z jednym atomem tlenu. Inny przykład to sól kuchenna (NaCl), czyli połączenie sodu (Na) i chloru (Cl).
Mieszaniny
Oprócz pierwiastków i związków chemicznych mamy także mieszaniny. Mieszaniny to połączenia dwóch lub więcej substancji, które nie łączą się ze sobą chemicznie. Inaczej mówiąc, każda substancja w mieszaninie zachowuje swoje własne właściwości.
Mieszaniny dzielimy na:
- Jednorodne: Substancje są równomiernie wymieszane i nie widać ich gołym okiem. Przykład: powietrze (mieszanina azotu, tlenu i innych gazów), woda z solą.
- Niejednorodne: Substancje nie są równomiernie wymieszane i można je rozróżnić gołym okiem. Przykład: piasek z wodą, zupa z warzywami.
Stany skupienia materii
Materia może występować w różnych stanach skupienia, które zależą od temperatury i ciśnienia. Najczęściej spotykamy trzy stany skupienia:
- Stały: Cząsteczki są ściśle ułożone i mają określone położenie. Substancje w stanie stałym mają określony kształt i objętość. Przykład: lód, drewno, metal.
- Ciekły: Cząsteczki mogą się swobodnie przemieszczać, ale nadal są blisko siebie. Substancje w stanie ciekłym mają określoną objętość, ale przyjmują kształt naczynia, w którym się znajdują. Przykład: woda, olej, sok.
- Gazowy: Cząsteczki poruszają się bardzo swobodnie i zajmują całą dostępną przestrzeń. Substancje w stanie gazowym nie mają określonego kształtu ani objętości. Przykład: powietrze, para wodna, dwutlenek węgla.
Oprócz tych trzech stanów skupienia, istnieją także inne, np. plazma, która występuje w bardzo wysokich temperaturach (np. w Słońcu).
Zmiany Stanu Skupienia
Substancje mogą zmieniać stan skupienia w zależności od temperatury. Te zmiany nazywamy przemianami fazowymi:
- Topnienie: Przejście ze stanu stałego w ciekły (np. lód topnieje i zamienia się w wodę).
- Krzepnięcie (zamarzanie): Przejście ze stanu ciekłego w stały (np. woda zamarza i zamienia się w lód).
- Parowanie: Przejście ze stanu ciekłego w gazowy (np. woda paruje i zamienia się w parę wodną).
- Skraplanie: Przejście ze stanu gazowego w ciekły (np. para wodna skrapla się na zimnej szybie i zamienia się w wodę).
- Sublimacja: Przejście ze stanu stałego w gazowy, z pominięciem stanu ciekłego (np. suchy lód – dwutlenek węgla w stanie stałym – sublimuje i zamienia się bezpośrednio w gazowy dwutlenek węgla).
- Resublimacja: Przejście ze stanu gazowego w stały, z pominięciem stanu ciekłego (np. szron).
Właściwości Materii
Właściwości materii to cechy, które pozwalają nam ją opisać i odróżnić od innych substancji. Dzielimy je na:
-
Właściwości fizyczne: Można je zmierzyć i zaobserwować bez zmiany składu chemicznego substancji. Przykłady:
- Gęstość: Stosunek masy do objętości (np. żelazo jest gęstsze od drewna).
- Temperatura wrzenia: Temperatura, w której ciecz zaczyna wrzeć (np. woda wrze w 100 stopniach Celsjusza).
- Temperatura topnienia: Temperatura, w której ciało stałe zaczyna topnieć (np. lód topnieje w 0 stopniach Celsjusza).
- Rozpuszczalność: Zdolność substancji do rozpuszczania się w innej substancji (np. cukier dobrze rozpuszcza się w wodzie).
- Przewodnictwo cieplne i elektryczne: Zdolność do przewodzenia ciepła i prądu elektrycznego (np. metale dobrze przewodzą ciepło i prąd).
- Barwa, zapach, smak: Cechy, które możemy zaobserwować zmysłami.
-
Właściwości chemiczne: Opisują, jak substancja reaguje z innymi substancjami. Obserwacja właściwości chemicznych wiąże się ze zmianą składu chemicznego substancji. Przykłady:
- Palność: Zdolność do spalania się (np. drewno jest palne, a żelazo nie).
- Reaktywność: Zdolność do reagowania z innymi substancjami (np. sód gwałtownie reaguje z wodą).
- Kwasowość i zasadowość: Właściwości związane z obecnością jonów wodorowych (H⁺) i jonów wodorotlenkowych (OH⁻) w roztworach.
Mam nadzieję, że teraz budowa i właściwości materii są dla Was bardziej zrozumiałe. Pamiętajcie, że to tylko wprowadzenie do tematu. Im więcej będziecie się uczyć i eksperymentować, tym lepiej zrozumiecie otaczający Was świat! Powodzenia na sprawdzianie!