Wiązanie Jonowe Kowalencyjne Spolaryzowane I Niespolaryzowane

Dzień dobry wszystkim! Widzę, że macie pytania dotyczące wiązań chemicznych. To bardzo ważny temat, więc postaram się wszystko wyjaśnić jak najprościej. Skupimy się na wiązaniu jonowym, kowalencyjnym spolaryzowanym i niespolaryzowanym.
Zacznijmy od samego początku. Wyobraźcie sobie, że atomy są jak ludzie. Niektóre są bardzo towarzyskie i lubią dzielić się swoimi rzeczami, a inne są bardziej samolubne i wolą wszystko zatrzymać dla siebie. Tak samo jest z atomami i elektronami. Elektrony są jak małe kuleczki, które krążą wokół atomu i decydują o jego właściwościach chemicznych. Atomy dążą do tego, by mieć pełną "skorupę" elektronową, czyli określoną liczbę elektronów na ostatniej warstwie.
Wiązanie Jonowe: Kradzież Elektronów
Wiązanie jonowe powstaje wtedy, gdy jeden atom jest bardzo "chciwy" i kradnie elektron drugiemu atomowi. Mówiąc dokładniej, jeden atom oddaje elektron(y), a drugi je przyjmuje. To tak, jakby silniejszy kolega zabrał zabawkę słabszemu. Ten, który oddał elektron, staje się jonem dodatnim (kationem), ponieważ ma teraz więcej protonów (cząstek dodatnich) niż elektronów (cząstek ujemnych). Ten, który przyjął elektron, staje się jonem ujemnym (anionem), bo ma więcej elektronów niż protonów.
Przykładem jest chlorek sodu, czyli sól kuchenna (NaCl). Sód (Na) bardzo łatwo oddaje jeden elektron, a chlor (Cl) bardzo chętnie go przyjmuje. Sód oddaje elektron chlorowi. Wtedy sód staje się kationem Na+, a chlor anionem Cl-. Te dwa jony przyciągają się nawzajem, ponieważ mają przeciwne ładunki (plus i minus się przyciągają). To przyciąganie elektrostatyczne utrzymuje je razem i tworzy wiązanie jonowe. Powstaje kryształ soli kuchennej, w którym jony Na+ i Cl- są ułożone w regularną sieć.
Wiązania jonowe są bardzo mocne. Dlatego substancje jonowe, takie jak sól, mają wysokie temperatury topnienia i wrzenia. Trzeba dużo energii, żeby rozerwać to silne przyciąganie między jonami. Substancje jonowe dobrze rozpuszczają się w wodzie, ponieważ woda ma właściwości polarne i może oddzielać jony od siebie.
Wiązanie Kowalencyjne: Dzielenie się Elektronami
Wiązanie kowalencyjne powstaje wtedy, gdy atomy nie chcą ani oddawać, ani przyjmować elektronów, ale potrzebują ich, żeby mieć pełną "skorupę". Wtedy decydują się na dzielenie się elektronami. To tak, jakby dwóch kolegów miało jedną zabawkę i bawiło się nią razem.
Wiązanie kowalencyjne powstaje najczęściej między atomami niemetali. Istnieją dwa rodzaje wiązań kowalencyjnych: spolaryzowane i niespolaryzowane.
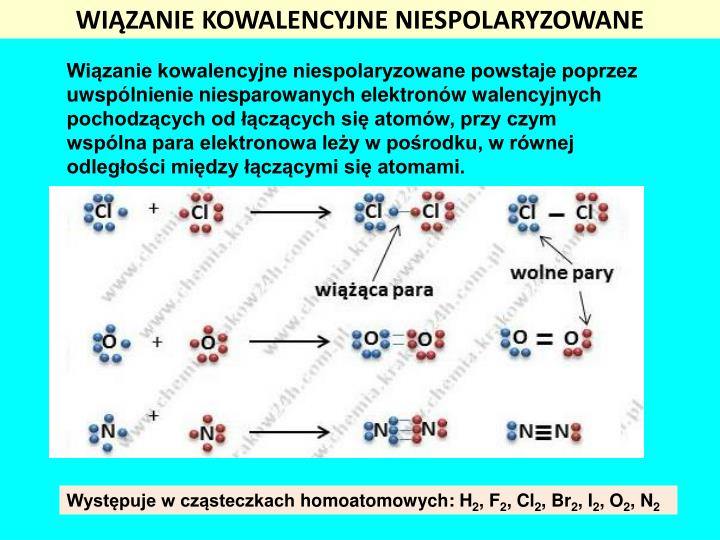
Wiązanie Kowalencyjne Niespolaryzowane: Równy Podział
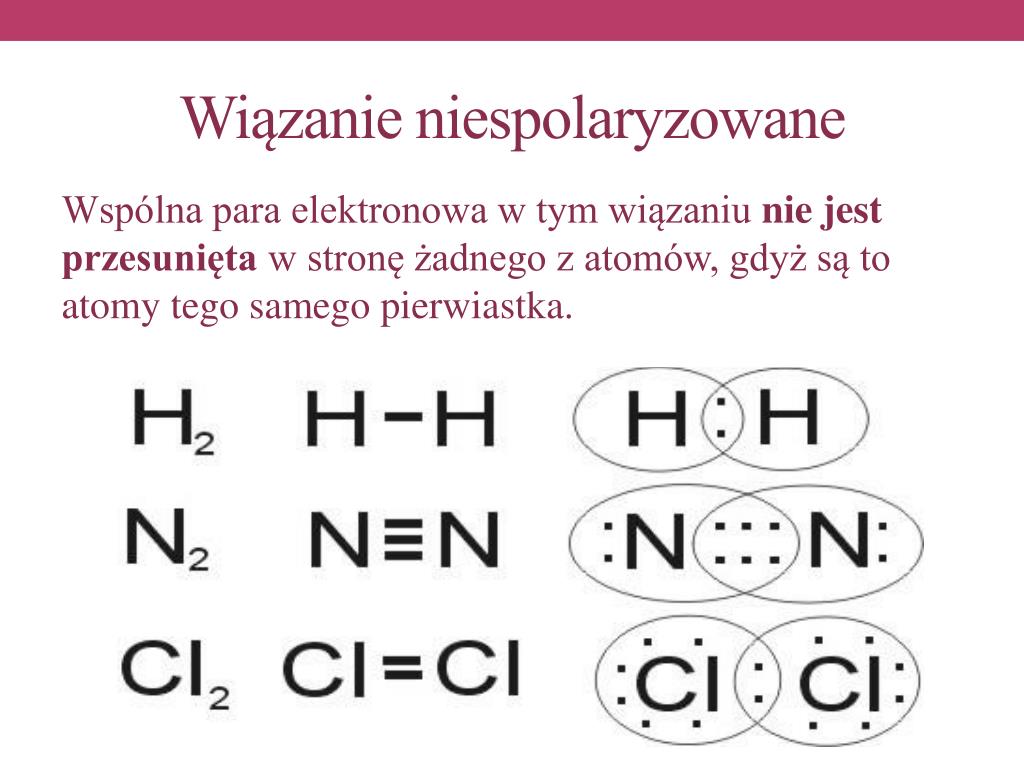
Wiązanie kowalencyjne niespolaryzowane powstaje wtedy, gdy atomy dzielą się elektronami równo. Oznacza to, że żaden z atomów nie przyciąga elektronów bardziej niż drugi. Dzieje się tak, gdy atomy są takie same, albo mają bardzo zbliżoną elektroujemność (czyli zdolność do przyciągania elektronów).
Przykładem jest cząsteczka wodoru (H2). Dwa atomy wodoru dzielą się swoimi elektronami, tworząc wiązanie kowalencyjne. Ponieważ oba atomy wodoru są identyczne, przyciągają elektrony z taką samą siłą. Elektrony krążą równomiernie wokół obu atomów.
Innym przykładem jest cząsteczka tlenu (O2) lub azotu (N2). W tych cząsteczkach atomy są identyczne i dlatego wiązanie jest niespolaryzowane.
Substancje z wiązaniami kowalencyjnymi niespolaryzowanymi zazwyczaj słabo rozpuszczają się w wodzie i mają niskie temperatury topnienia i wrzenia.
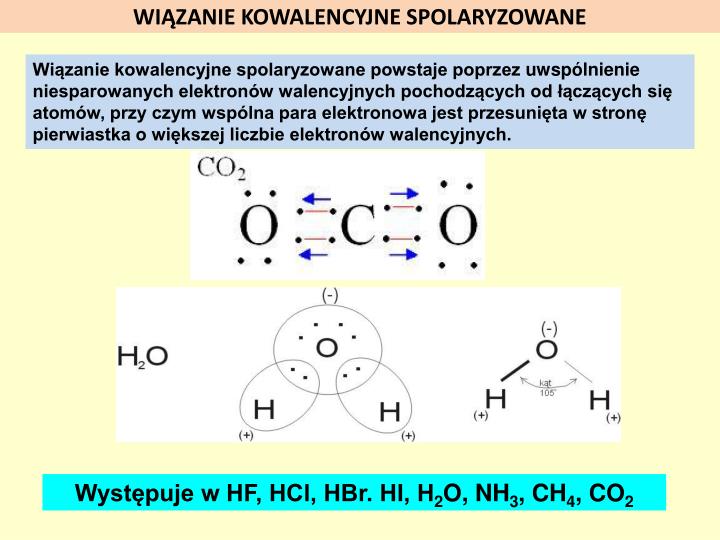
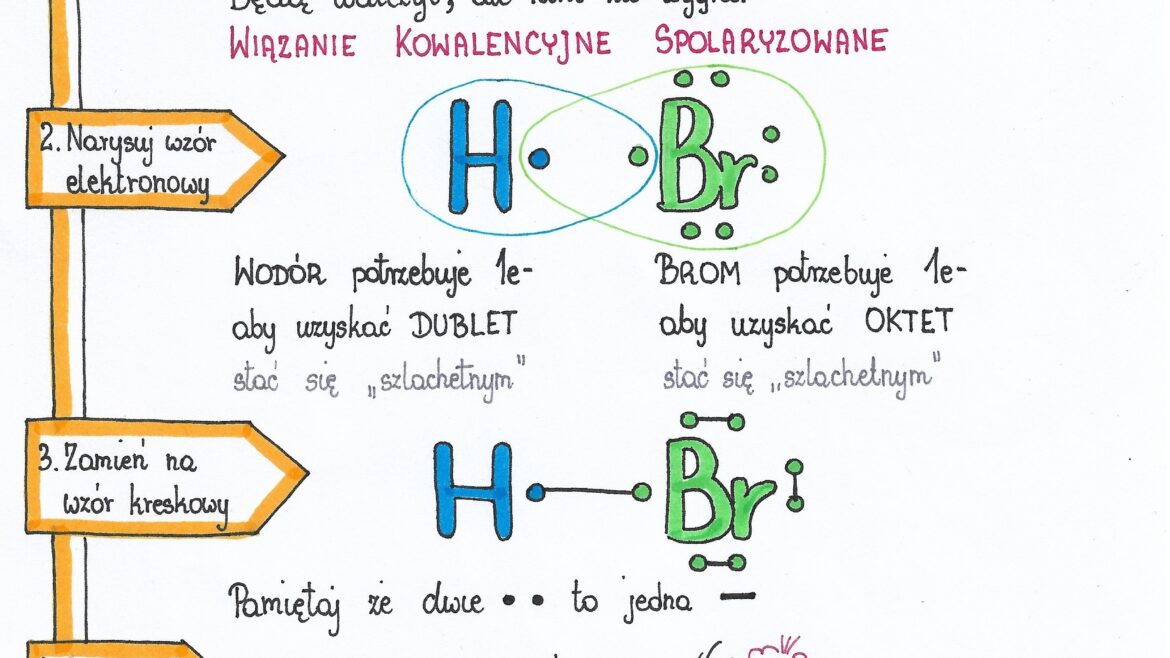
Wiązanie Kowalencyjne Spolaryzowane: Nierówny Podział
Wiązanie kowalencyjne spolaryzowane powstaje wtedy, gdy atomy dzielą się elektronami nierówno. Jeden atom przyciąga elektrony silniej niż drugi. To tak, jakby jeden z kolegów częściej bawił się zabawką niż drugi. Dzieje się tak, gdy atomy mają różną elektroujemność. Atom o wyższej elektroujemności przyciąga elektrony mocniej i staje się częściowo naładowany ujemnie (δ-), a atom o niższej elektroujemności staje się częściowo naładowany dodatnio (δ+).
Przykładem jest cząsteczka wody (H2O). Tlen (O) jest bardziej elektroujemny niż wodór (H). Oznacza to, że tlen przyciąga elektrony silniej niż wodór. Elektrony spędzają więcej czasu w pobliżu tlenu, przez co tlen staje się częściowo naładowany ujemnie (δ-), a wodory stają się częściowo naładowane dodatnio (δ+). Powstaje dipol – cząsteczka z dwoma biegunami: dodatnim i ujemnym.
Innym przykładem jest cząsteczka chlorowodoru (HCl). Chlor jest bardziej elektroujemny niż wodór, więc przyciąga elektrony silniej. Chlor staje się częściowo naładowany ujemnie (δ-), a wodór częściowo naładowany dodatnio (δ+).
Substancje z wiązaniami kowalencyjnymi spolaryzowanymi zazwyczaj lepiej rozpuszczają się w wodzie niż substancje z wiązaniami niespolaryzowanymi, ponieważ woda jest polarna i może oddziaływać z polarnymi cząsteczkami. Mają też wyższe temperatury topnienia i wrzenia niż substancje z wiązaniami niespolaryzowanymi, ale niższe niż substancje jonowe.
Pamiętajcie, że wiązania chemiczne to bardzo ważny temat w chemii. Zrozumienie różnic między wiązaniami jonowymi, kowalencyjnymi spolaryzowanymi i niespolaryzowanymi pomoże Wam zrozumieć właściwości różnych substancji i reakcji chemicznych. Starajcie się zapamiętać te przykłady, które podałem. Dzięki nim łatwiej będzie wam rozpoznać typ wiązania w konkretnej cząsteczce. Powodzenia w dalszej nauce chemii!