Wiązania Jonowe Kowalencyjne Spolaryzowane I Niespolaryzowane

Dzień dobry wszystkim! Widzę, że mamy dziś trochę pytań o wiązania chemiczne. Spróbuję wam to wyjaśnić w prosty i zrozumiały sposób. Zaczniemy od wiązania jonowego, potem przejdziemy do kowalencyjnego, rozróżniając je na spolaryzowane i niespolaryzowane. Gotowi? Zaczynamy!
Wiązanie Jonowe: Jak magnesy z przeciwnymi biegunami
Wyobraźcie sobie dwa magnesy. Jeden ma biegun dodatni, a drugi ujemny. Jak myślicie, co się stanie, kiedy je zbliżymy? Oczywiście, przyciągną się! Wiązanie jonowe działa trochę na tej samej zasadzie.
Wiązanie jonowe powstaje między atomami, które mają bardzo różne upodobania do elektronów. Mówimy, że mają dużą różnicę elektroujemności. Jeden atom jest bardzo chętny, żeby elektrony oddać, a drugi bardzo chętny, żeby je przyjąć. Ten, który oddaje elektrony, staje się jonem dodatnim (kationem), a ten, który przyjmuje elektrony, staje się jonem ujemnym (anionem).
No dobrze, ale co to znaczy "chętny oddać" i "chętny przyjąć"? Spójrzmy na przykład na sól kuchenną – chlorek sodu (NaCl). Sód (Na) ma tylko jeden elektron na swojej zewnętrznej powłoce i bardzo łatwo się go pozbywa, żeby osiągnąć stabilną konfigurację elektronową. Chlor (Cl) ma na swojej zewnętrznej powłoce siedem elektronów i bardzo chętnie przyjmie jeden, żeby mieć pełną ósemkę, czyli oktet elektronowy.
Kiedy sód oddaje swój elektron chlorowi, sód staje się jonem Na+ (kationem), a chlor staje się jonem Cl- (anionem). Te dwa jony, naładowane przeciwnie, przyciągają się bardzo mocno, tworząc wiązanie jonowe.
Właściwości związków jonowych są dość charakterystyczne. Zwykle są to ciała stałe o wysokich temperaturach topnienia i wrzenia. Dlaczego? Bo to przyciąganie między jonami jest bardzo silne i trzeba dostarczyć dużo energii, żeby je rozerwać. Rozpuszczają się też dobrze w wodzie, ponieważ woda "rozbija" sieć jonową na poszczególne jony, które są otaczane przez cząsteczki wody. Ponadto, roztwory i stopione związki jonowe przewodzą prąd elektryczny, ponieważ jony mogą się swobodnie poruszać i przenosić ładunek.
Wiązania Kowalencyjne: Dzielimy się, żeby było nam dobrze
Teraz przechodzimy do wiązań kowalencyjnych. Tutaj już nie ma oddawania i przyjmowania elektronów. Zamiast tego, atomy "dzielą się" elektronami, żeby każdy z nich miał pełną powłokę walencyjną (zwykle 8 elektronów, czyli oktet).
Wyobraźcie sobie, że macie dwóch przyjaciół, którzy mają po 7 cukierków, a chcą mieć po 8. Mogą się ze sobą podzielić jednym cukierkiem i wtedy każdy z nich będzie miał 8! To właśnie robią atomy w wiązaniu kowalencyjnym.
Wiązanie kowalencyjne tworzy się między atomami o podobnej elektroujemności. Oznacza to, że oba atomy mają podobną "siłę" przyciągania elektronów.
Wiązanie Kowalencyjne Niespolaryzowane: Równy podział
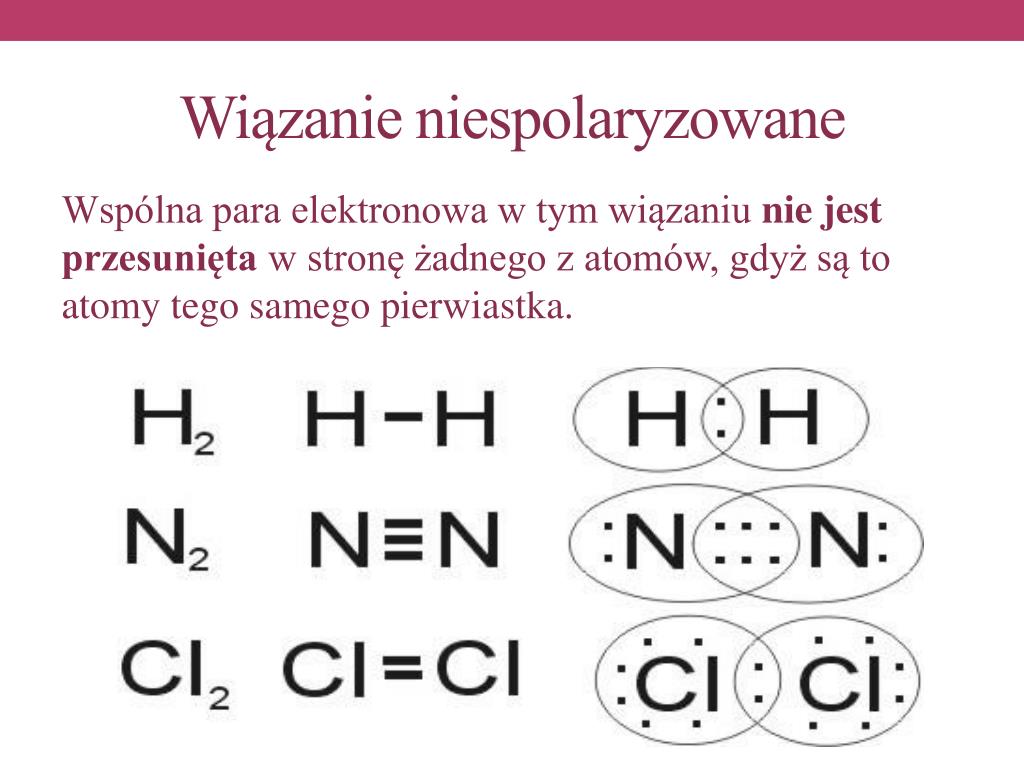
Najpierw zajmiemy się wiązaniem kowalencyjnym niespolaryzowanym. W tym przypadku, atomy dzielą się elektronami dokładnie po równo. Dzieje się tak, gdy wiązanie tworzy się między dwoma identycznymi atomami, na przykład w cząsteczce wodoru (H2) albo tlenu (O2). Oba atomy wodoru mają taką samą elektroujemność, więc elektrony są przyciągane do każdego z nich z taką samą siłą. W rezultacie, gęstość elektronowa jest rozłożona symetrycznie między atomami, a nie ma żadnych obszarów z nadmiarem ładunku dodatniego lub ujemnego.
Związki z wiązaniami kowalencyjnymi niespolaryzowanymi zwykle mają niskie temperatury topnienia i wrzenia, ponieważ siły między cząsteczkami są słabe. Są również słabo rozpuszczalne w wodzie, która jest związkiem polarnym (o tym zaraz).
Wiązanie Kowalencyjne Spolaryzowane: Trochę mniej po równo
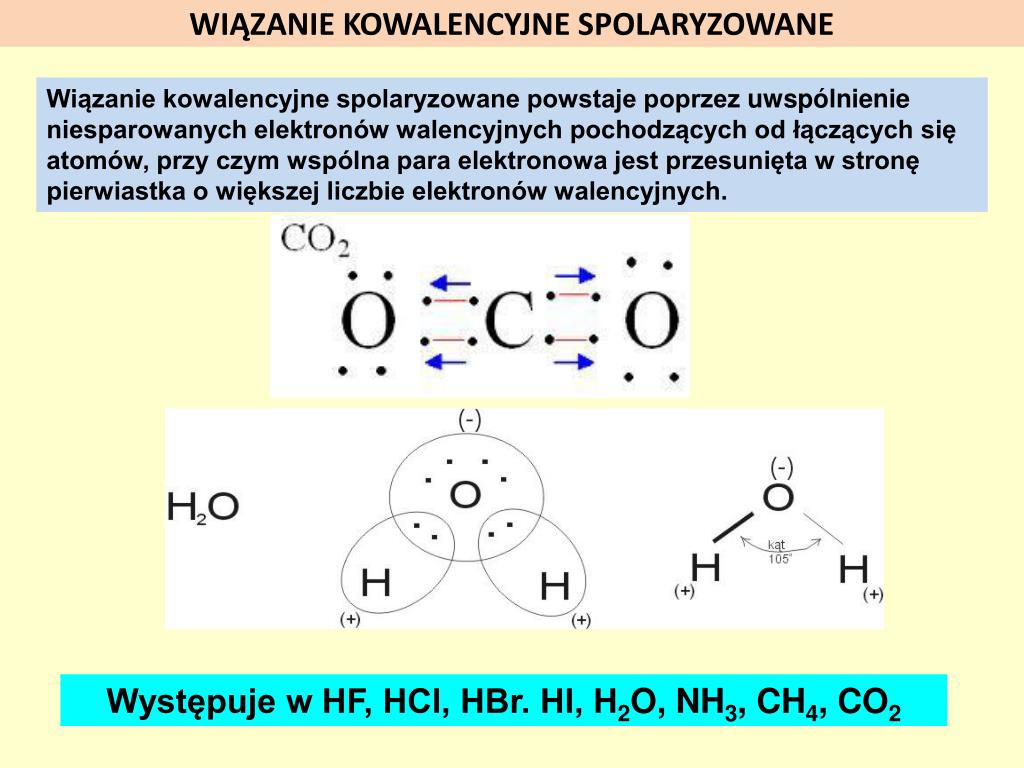
Teraz dochodzimy do wiązania kowalencyjnego spolaryzowanego. Tutaj podział elektronów nie jest już taki równy. Dzieje się tak, gdy wiązanie tworzy się między atomami o różnej elektroujemności, ale ta różnica nie jest na tyle duża, żeby doszło do utworzenia wiązania jonowego.
Jeden z atomów (ten bardziej elektroujemny) przyciąga elektrony wiążące silniej niż drugi. W rezultacie, gęstość elektronowa jest przesunięta w stronę atomu bardziej elektroujemnego. Powstaje wtedy częściowy ładunek ujemny (oznaczany symbolem δ-) na atomie bardziej elektroujemnym i częściowy ładunek dodatni (δ+) na atomie mniej elektroujemnym.
Przykładem może być woda (H2O). Tlen jest bardziej elektroujemny niż wodór, więc przyciąga elektrony wiążące silniej. W rezultacie, atom tlenu ma częściowy ładunek ujemny (δ-), a atomy wodoru mają częściowe ładunki dodatnie (δ+). Mówimy, że cząsteczka wody jest polarna, czyli ma dwa bieguny – jeden dodatni i jeden ujemny.
Co to oznacza dla właściwości?
Polarne wiązania wpływają na właściwości związków. Związki polarne zwykle mają wyższe temperatury topnienia i wrzenia niż związki niepolarne o podobnej masie cząsteczkowej, ponieważ siły międzycząsteczkowe (np. oddziaływania dipol-dipol) są silniejsze. Co ważne, "podobne rozpuszcza się w podobnym" – związki polarne rozpuszczają się dobrze w polarnych rozpuszczalnikach (takich jak woda), a związki niepolarne rozpuszczają się dobrze w niepolarnych rozpuszczalnikach (takich jak benzen).
Podsumowując…
- Wiązanie jonowe: Powstaje przez przekazanie elektronów między atomami o dużej różnicy elektroujemności. Powstają jony o przeciwnych ładunkach, które się przyciągają.
- Wiązanie kowalencyjne: Powstaje przez dzielenie się elektronami między atomami.
- Wiązanie kowalencyjne niespolaryzowane: Elektrony są dzielone po równo, zwykle między identycznymi atomami.
- Wiązanie kowalencyjne spolaryzowane: Elektrony są dzielone nierówno, jeden atom przyciąga je silniej.
Mam nadzieję, że to wyjaśnienie było pomocne! Pamiętajcie, żeby myśleć o wiązaniach chemicznych jak o różnych sposobach, w jakie atomy łączą się ze sobą, żeby osiągnąć stabilność. Każdy typ wiązania ma swoje własne cechy i wpływa na właściwości związku. Jeśli macie jeszcze jakieś pytania, śmiało pytajcie!