W Roztworze Wodorotlenku Wapnia Na Jeden Jon Wodorotlenkowy
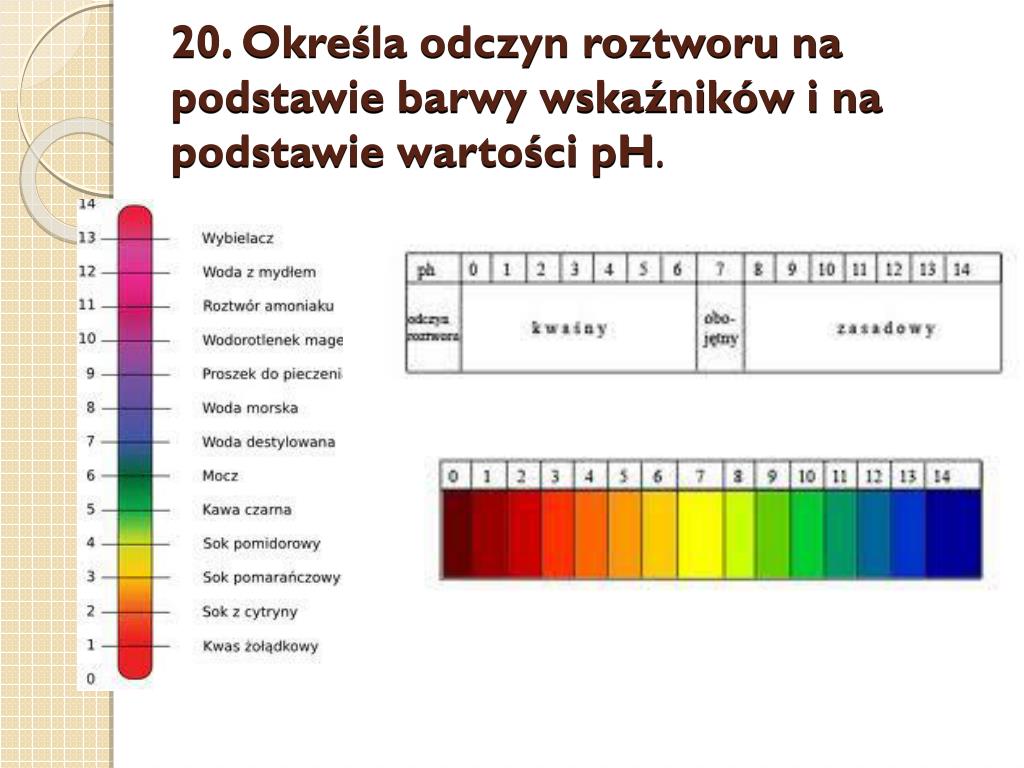
Dobrze, spróbuję wyjaśnić, co dzieje się, gdy w roztworze wodorotlenku wapnia (czyli w wodzie wapiennej) przypada jeden jon wodorotlenkowy (OH-). To może brzmieć trochę skomplikowanie, ale postaram się to uprościć.
Zacznijmy od samego wodorotlenku wapnia. Jest to związek chemiczny o wzorze Ca(OH)2. Kiedy go rozpuszczamy w wodzie, zachodzi pewien proces, który nazywamy dysocjacją. Najprościej mówiąc, wodorotlenek wapnia rozpada się na jony.
Te jony to:
- Jon wapnia (Ca2+) – czyli atom wapnia, który stracił dwa elektrony, dlatego ma ładunek dodatni 2+.
- Jon wodorotlenkowy (OH-) – czyli grupa atomów: tlenu i wodoru, która zyskała elektron, dlatego ma ładunek ujemny 1-.
Dysocjację wodorotlenku wapnia możemy zapisać w następujący sposób:
Ca(OH)2 → Ca2+ + 2OH-
Co to znaczy? Znaczy to, że jedna cząsteczka wodorotlenku wapnia (Ca(OH)2) rozpada się na jeden jon wapnia (Ca2+) i dwa jony wodorotlenkowe (2OH-). I to jest kluczowe do zrozumienia, co się dzieje, gdy chcemy mieć "jeden jon wodorotlenkowy".
Wyobraźmy sobie, że mamy bardzo, bardzo małą ilość wodorotlenku wapnia w wodzie. Tak małą, że na każdy jon wapnia przypada tylko jeden jon wodorotlenkowy. Z równania dysocjacji wiemy, że to teoretycznie niemożliwe, bo z jednej cząsteczki Ca(OH)2 powstają dwa OH-. W idealnym roztworze, powstałym wyłącznie z rozpuszczenia Ca(OH)2, zawsze będzie dwa razy więcej jonów OH- niż jonów Ca2+.
Jednak w praktyce, w rzeczywistym roztworze, sytuacja może być nieco bardziej skomplikowana. Może dojść do obecności innych substancji, które wpływają na liczbę jonów wodorotlenkowych. Na przykład, jeśli do roztworu dodamy jakiś kwas, to kwas ten zareaguje z jonami wodorotlenkowymi, zmniejszając ich liczbę.
Aby zrozumieć, jak możemy teoretycznie dążyć do sytuacji, w której "na jeden jon wapnia przypada jeden jon wodorotlenkowy" (choć tak naprawdę jest to trudne do osiągnięcia w czystym roztworze wodorotlenku wapnia), musimy zastanowić się, jak możemy wpływać na stężenia tych jonów.
Co mogłoby się stać, gdybyśmy mieli inne źródło jonów Ca2+?
Gdybyśmy wprowadzili do roztworu jony wapnia z innego źródła niż wodorotlenek wapnia, na przykład rozpuszczając chlorek wapnia (CaCl2), to moglibyśmy zwiększyć stężenie jonów wapnia bez jednoczesnego zwiększania stężenia jonów wodorotlenkowych.
Chlorek wapnia dysocjuje w wodzie w następujący sposób:
CaCl2 → Ca2+ + 2Cl-
Czyli, jedna cząsteczka chlorku wapnia daje jeden jon wapnia i dwa jony chlorkowe (Cl-). Dodając chlorek wapnia do roztworu wodorotlenku wapnia, zwiększamy stężenie Ca2+, ale nie wpływamy bezpośrednio na stężenie OH-. W ten sposób możemy teoretycznie zbliżyć się do sytuacji, w której stosunek jonów Ca2+ do OH- wynosi 1:1. Ale pamiętajmy, że w roztworze nadal będą obecne jony OH- pochodzące z dysocjacji Ca(OH)2.
A co, gdybyśmy zmniejszyli ilość jonów OH-?
Jak już wspomniałem, dodanie kwasu do roztworu obniżyłoby stężenie jonów OH-. Kwasy, ogólnie rzecz biorąc, dysocjują w wodzie, uwalniając jony wodorowe (H+). Jony wodorowe reagują z jonami wodorotlenkowymi, tworząc wodę (H2O):
H+ + OH- → H2O
Ta reakcja "neutralizuje" jony wodorotlenkowe, zmniejszając ich stężenie. Dodając odpowiednią ilość kwasu, teoretycznie moglibyśmy obniżyć stężenie OH- tak, aby zbliżyło się do stężenia Ca2+ (pochodzącego z dysocjacji Ca(OH)2).
Podsumowując:
W czystym roztworze wodorotlenku wapnia, na jeden jon wapnia (Ca2+) zawsze przypadają dwa jony wodorotlenkowe (OH-). Wynika to bezpośrednio z dysocjacji Ca(OH)2.
Aby teoretycznie zbliżyć się do sytuacji, w której na jeden jon wapnia przypada jeden jon wodorotlenkowy, musielibyśmy:
- Dodać do roztworu inne źródło jonów wapnia (np. chlorek wapnia) bez dodawania jonów wodorotlenkowych.
- Zmniejszyć stężenie jonów wodorotlenkowych, na przykład poprzez dodanie kwasu, który reaguje z OH- i tworzy wodę.
Jednak w praktyce, osiągnięcie idealnego stosunku 1:1 jest trudne i w roztworze będą obecne jony pochodzące z różnych źródeł. Kluczowe jest zrozumienie, że dysocjacja wodorotlenku wapnia zawsze daje dwa razy więcej jonów OH- niż jonów Ca2+ z samego Ca(OH)2. Dopiero dodanie innych substancji może zmodyfikować ten stosunek w całym roztworze.
Mam nadzieję, że to wyjaśnienie jest zrozumiałe. Pamiętaj, że chemia to dziedzina, która wymaga dokładności, a to uproszczone wyjaśnienie ma na celu pomóc Ci zrozumieć podstawowe zasady.








