Uzupełnij Tabele Zapisz Wzory Sumaryczne Lub Nazwy Związków Chemicznych

Dobrze, przygotujmy się do wypełnienia tabel dotyczących wzorów sumarycznych i nazw związków chemicznych. Poniżej przedstawiam wyczerpujące informacje i instrukcje, które pomogą w zadaniu.
Zacznijmy od systematycznego podejścia do identyfikacji i zapisu wzorów oraz nazw.
Wzory Sumaryczne i Nazewnictwo Związków Nieorganicznych
Najpierw omówimy związki nieorganiczne, ponieważ ich nazewnictwo jest bardziej uporządkowane i łatwiejsze do zrozumienia. Wyróżniamy kilka podstawowych typów związków: tlenki, wodorotlenki, kwasy i sole.
-
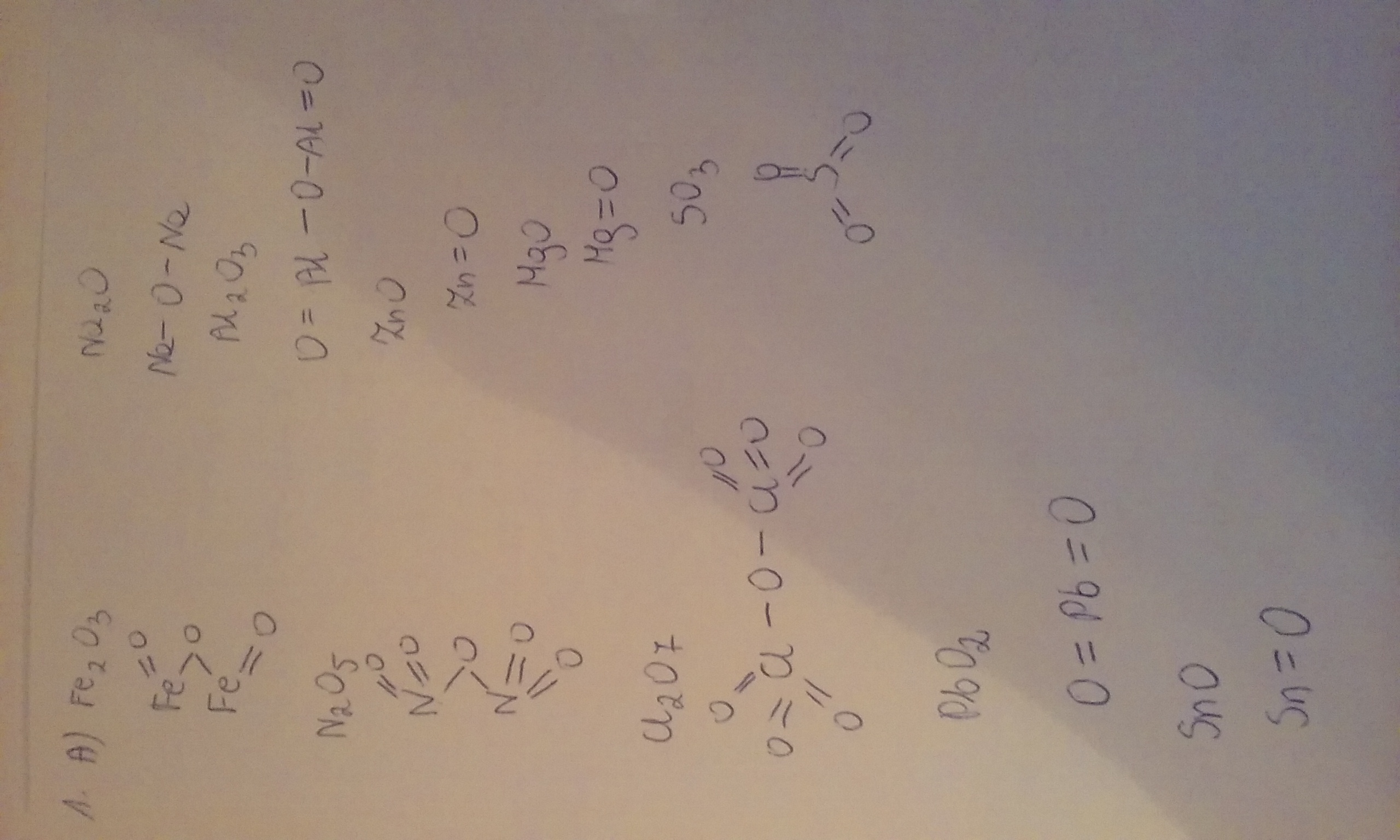
Tlenki:
Wzór ogólny: EₓOᵧ, gdzie E to pierwiastek, a x i y wynikają z wartościowości pierwiastka i tlenu (zawsze II). Nazwy tworzy się, dodając słowo "tlenek" i nazwę pierwiastka z określeniem jego wartościowości w nawiasie, jeśli pierwiastek przyjmuje różne wartościowości.
- Na₂O: tlenek sodu
- Fe₂O₃: tlenek żelaza(III)
- CO₂: tlenek węgla(IV)
- SO₃: tlenek siarki(VI)
-
Wodorotlenki:
Wzór ogólny: E(OH)ₓ, gdzie E to metal, a x to jego wartościowość. Nazwy tworzy się, dodając słowo "wodorotlenek" i nazwę metalu z określeniem jego wartościowości w nawiasie, jeśli metal przyjmuje różne wartościowości.
- NaOH: wodorotlenek sodu
- Ca(OH)₂: wodorotlenek wapnia
- Fe(OH)₃: wodorotlenek żelaza(III)
-
Kwasy:
Tutaj sprawa jest trochę bardziej skomplikowana, ponieważ mamy kwasy tlenowe i beztlenowe.
-
Kwasy beztlenowe: Wzór ogólny: HₓE, gdzie E to niemetal (np. chlor, siarka), a x to wartościowość niemetalu. Nazwy tworzy się, dodając słowo "kwas" i nazwę niemetalu z końcówką "-owodorowy".
- HCl: kwas chlorowodorowy
- H₂S: kwas siarkowodorowy
-
Kwasy tlenowe: Wzór ogólny: HₓEₐOᵧ, gdzie E to niemetal (np. siarka, azot, fosfor), a x, a, y zależą od wartościowości niemetalu i liczby atomów tlenu. Nazwy tworzy się, dodając słowo "kwas" i nazwę niemetalu z odpowiednią końcówką zależną od wartościowości niemetalu i liczby atomów tlenu.
- H₂SO₄: kwas siarkowy(VI)
- HNO₃: kwas azotowy(V)
- H₃PO₄: kwas fosforowy(V)
- H₂CO₃: kwas węglowy
-
-
Sole:
Powstają w wyniku reakcji kwasu z zasadą (wodorotlenkiem) lub metalem. Wzór ogólny: MₓRᵧ, gdzie M to metal lub kation amonu (NH₄⁺), a R to reszta kwasowa. Nazwy tworzy się, dodając nazwę reszty kwasowej i nazwę metalu z określeniem jego wartościowości w nawiasie, jeśli metal przyjmuje różne wartościowości.
- NaCl: chlorek sodu
- CaCO₃: węglan wapnia
- FeCl₃: chlorek żelaza(III)
- CuSO₄: siarczan(VI) miedzi(II)
Wzory Sumaryczne i Nazewnictwo Związków Organicznych
Związki organiczne są znacznie bardziej różnorodne, ale istnieją pewne podstawowe zasady. Skupimy się na kilku podstawowych grupach: alkany, alkeny, alkiny, alkohole, aldehydy, ketony i kwasy karboksylowe.
-
Alkany:
Wzór ogólny: CₙH₂ₙ₊₂, gdzie n to liczba atomów węgla. Nazwy tworzy się, dodając końcówkę "-an" do rdzenia nazwy zależnego od liczby atomów węgla:
- n = 1: met- (metan CH₄)
- n = 2: et- (etan C₂H₆)
- n = 3: prop- (propan C₃H₈)
- n = 4: but- (butan C₄H₁₀)
- n = 5: pent- (pentan C₅H₁₂)
- n = 6: heks- (heksan C₆H₁₄)
-
Alkeny:
Wzór ogólny: CₙH₂ₙ, gdzie n to liczba atomów węgla. Zawierają jedno wiązanie podwójne. Nazwy tworzy się, dodając końcówkę "-en" do rdzenia nazwy zależnego od liczby atomów węgla:
- C₂H₄: eten (etylen)
- C₃H₆: propen
- C₄H₈: buten
-
Alkiny:
Wzór ogólny: CₙH₂ₙ₋₂, gdzie n to liczba atomów węgla. Zawierają jedno wiązanie potrójne. Nazwy tworzy się, dodając końcówkę "-in" do rdzenia nazwy zależnego od liczby atomów węgla:
- C₂H₂: etyn (acetylen)
- C₃H₄: propin
- C₄H₆: butin
-
Alkohole:
Zawierają grupę hydroksylową (-OH). Nazwy tworzy się, dodając końcówkę "-ol" do nazwy alkanu o tej samej liczbie atomów węgla:
- CH₃OH: metanol
- C₂H₅OH: etanol
- C₃H₇OH: propanol
-
Aldehydy:
Zawierają grupę aldehydową (-CHO). Nazwy tworzy się, dodając końcówkę "-al" do nazwy alkanu o tej samej liczbie atomów węgla:
- HCHO: metanal (formaldehyd)
- CH₃CHO: etanal (acetaldehyd)
-
Ketony:
Zawierają grupę karbonylową (C=O) wewnątrz łańcucha węglowego. Nazwy tworzy się, dodając końcówkę "-on" do nazwy alkanu o tej samej liczbie atomów węgla:
- CH₃COCH₃: propanon (aceton)
- CH₃COCH₂CH₃: butanon
-
Kwasy karboksylowe:
Zawierają grupę karboksylową (-COOH). Nazwy tworzy się, dodając słowo "kwas" i końcówkę "-owy" do nazwy alkanu o tej samej liczbie atomów węgla:
- HCOOH: kwas metanowy (kwas mrówkowy)
- CH₃COOH: kwas etanowy (kwas octowy)
Przykładowe Uzupełnienie Tabeli
Załóżmy, że mamy tabelę z kolumnami: Nazwa Związku i Wzór Sumaryczny. Oto kilka przykładów uzupełnienia:
- Nazwa Związku: Tlenek glinu, Wzór Sumaryczny: Al₂O₃
- Nazwa Związku: Wodorotlenek potasu, Wzór Sumaryczny: KOH
- Nazwa Związku: Kwas siarkowy(VI), Wzór Sumaryczny: H₂SO₄
- Nazwa Związku: Azotan(V) wapnia, Wzór Sumaryczny: Ca(NO₃)₂
- Nazwa Związku: Metan, Wzór Sumaryczny: CH₄
- Nazwa Związku: Etanol, Wzór Sumaryczny: C₂H₅OH
- Nazwa Związku: Kwas octowy, Wzór Sumaryczny: CH₃COOH
Dodatkowe Wskazówki
- Wartościowość: Zawsze sprawdzaj wartościowość pierwiastków, szczególnie w związkach nieorganicznych. Pamiętaj, że tlen ma zazwyczaj wartościowość II, a wodór I.
- Reszty kwasowe: Naucz się nazw i wzorów popularnych reszt kwasowych, takich jak siarczan(VI) (SO₄²⁻), azotan(V) (NO₃⁻), węglan (CO₃²⁻) i fosforan(V) (PO₄³⁻).
- Przedrostki: W nazewnictwie związków organicznych używaj przedrostków takich jak "di-", "tri-", "tetra-" do określenia liczby identycznych podstawników.
- Izomeria: Pamiętaj, że związki organiczne mogą mieć izomery, czyli różne struktury o tym samym wzorze sumarycznym. W nazewnictwie izomerów używa się dodatkowych oznaczeń (np. "n-", "izo-", "sec-", "tert-").
- Grupy funkcyjne: Zidentyfikuj grupy funkcyjne w związkach organicznych, aby łatwiej ustalić nazwę.
Podsumowanie
Wypełnianie tabel z wzorami sumarycznymi i nazwami związków chemicznych wymaga systematycznej wiedzy i umiejętności. Pamiętaj o wartościowościach pierwiastków, nazewnictwie związków nieorganicznych i organicznych, oraz o identyfikacji grup funkcyjnych. Zastosowanie tych zasad pozwoli na skuteczne uzupełnienie każdej tabeli.
H2 Przykłady i Dodatkowe Związki
Aby jeszcze bardziej ułatwić zadanie, rozważmy kilka dodatkowych przykładów, które mogą pojawić się w tabelach:
- Tlenki:
- K₂O: tlenek potasu
- MnO₂: tlenek manganu(IV)
- Cr₂O₃: tlenek chromu(III)
- Wodorotlenki:
- LiOH: wodorotlenek litu
- Zn(OH)₂: wodorotlenek cynku
- Al(OH)₃: wodorotlenek glinu
- Kwasy:
- HBr: kwas bromowodorowy
- H₂SO₃: kwas siarkowy(IV)
- HNO₂: kwas azotowy(III)
- Sole:
- AgCl: chlorek srebra(I)
- K₂SO₄: siarczan(VI) potasu
- Na₃PO₄: fosforan(V) sodu
- Związki Organiczne:
- C₅H₁₂: pentan
- C₂H₄: eten (etylen)
- C₃H₈O: propanol (możliwe izomery: propan-1-ol, propan-2-ol)
- CH₃CH₂CHO: propanal
- CH₃CH₂COCH₃: pentan-2-on
- CH₃CH₂COOH: kwas propanowy
Nazewnictwo Związków Złożonych
W przypadku bardziej złożonych związków, takich jak sole podwójne lub kompleksy, nazewnictwo staje się bardziej skomplikowane i wymaga znajomości dodatkowych reguł. Na przykład, w solach podwójnych, nazwy kationów i anionów wymienia się w kolejności alfabetycznej. W kompleksach, najpierw wymienia się ligandy (czyli cząsteczki lub jony otaczające centralny atom metalu), a następnie nazwę metalu z określeniem jego stopnia utlenienia w nawiasie.
Na przykład:
- KAl(SO₄)₂: siarczan(VI) glinowo-potasowy (ałun)
- [Cu(NH₃)₄]SO₄: siarczan(VI) tetraaminamiedzi(II)
Reakcje Chemiczne i Stechiometria
Uzupełnianie tabel może również obejmować reakcje chemiczne. W takim przypadku, konieczne jest poprawne zbilansowanie równania reakcji, aby liczba atomów każdego pierwiastka była taka sama po obu stronach równania. Na przykład:
- 2H₂ + O₂ → 2H₂O (synteza wody)
- CH₄ + 2O₂ → CO₂ + 2H₂O (spalanie metanu)
Znając stechiometrię reakcji, można obliczyć ilość produktów powstających z określonej ilości substratów.
Podsumowanie Końcowe
Mam nadzieję, że te szczegółowe informacje pomogą w skutecznym uzupełnianiu tabel z wzorami sumarycznymi i nazwami związków chemicznych. Pamiętaj, że systematyczna wiedza, dokładność i umiejętność identyfikacji typów związków są kluczowe do sukcesu. Powodzenia!