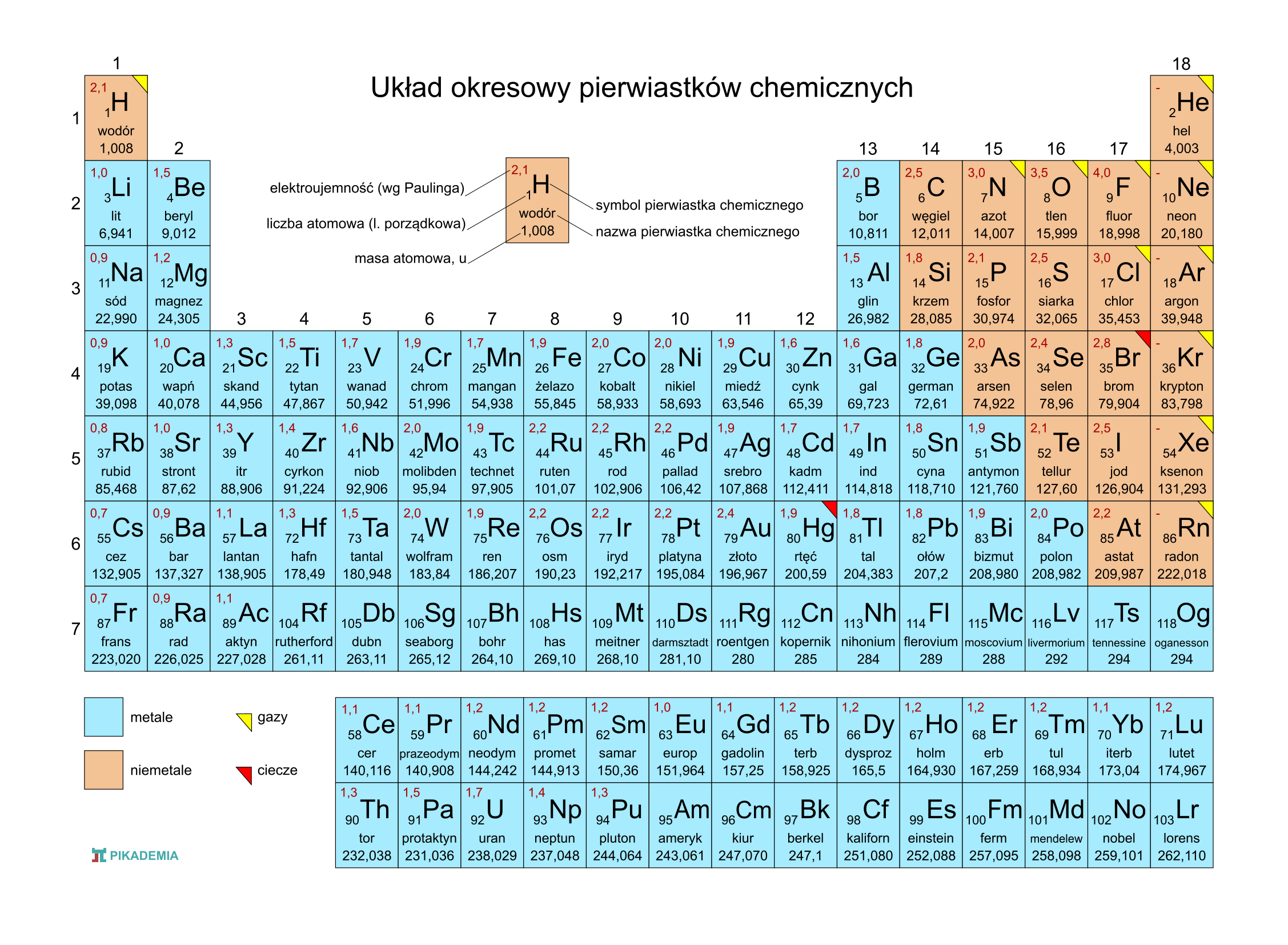
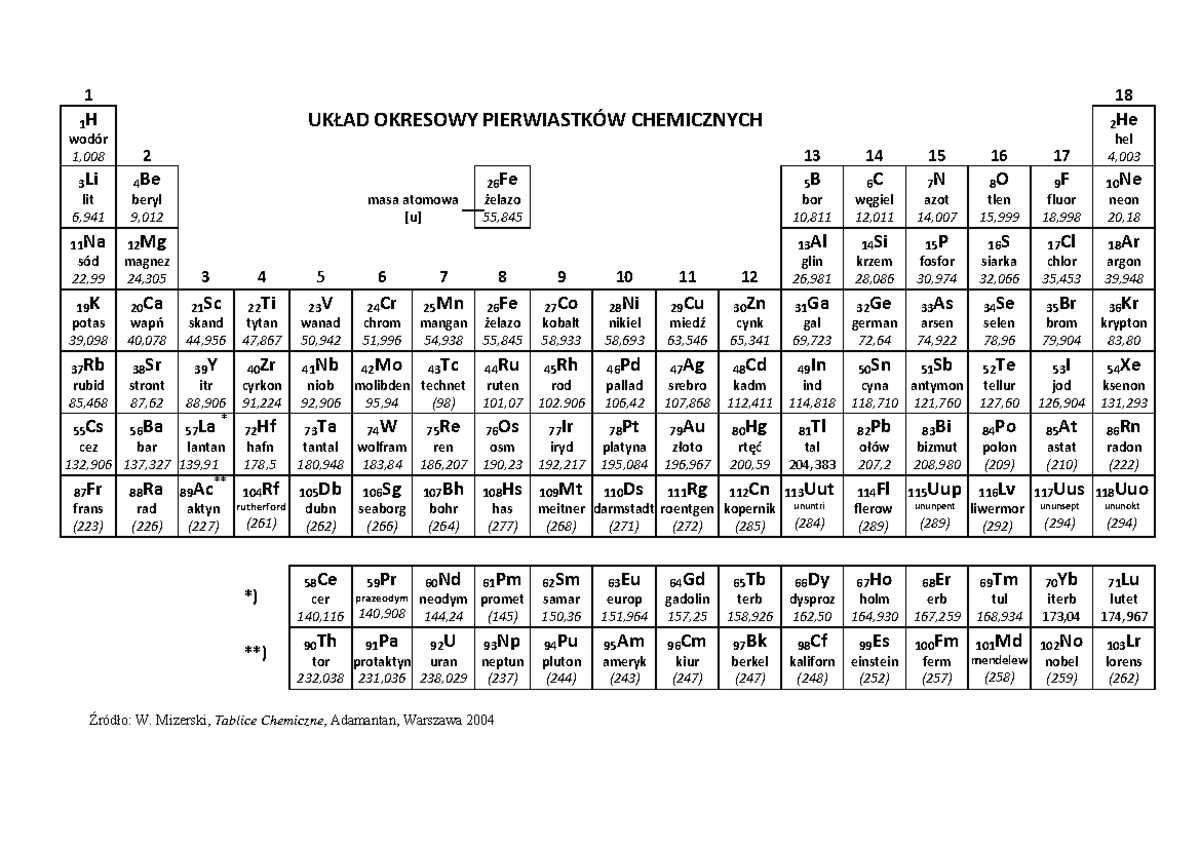
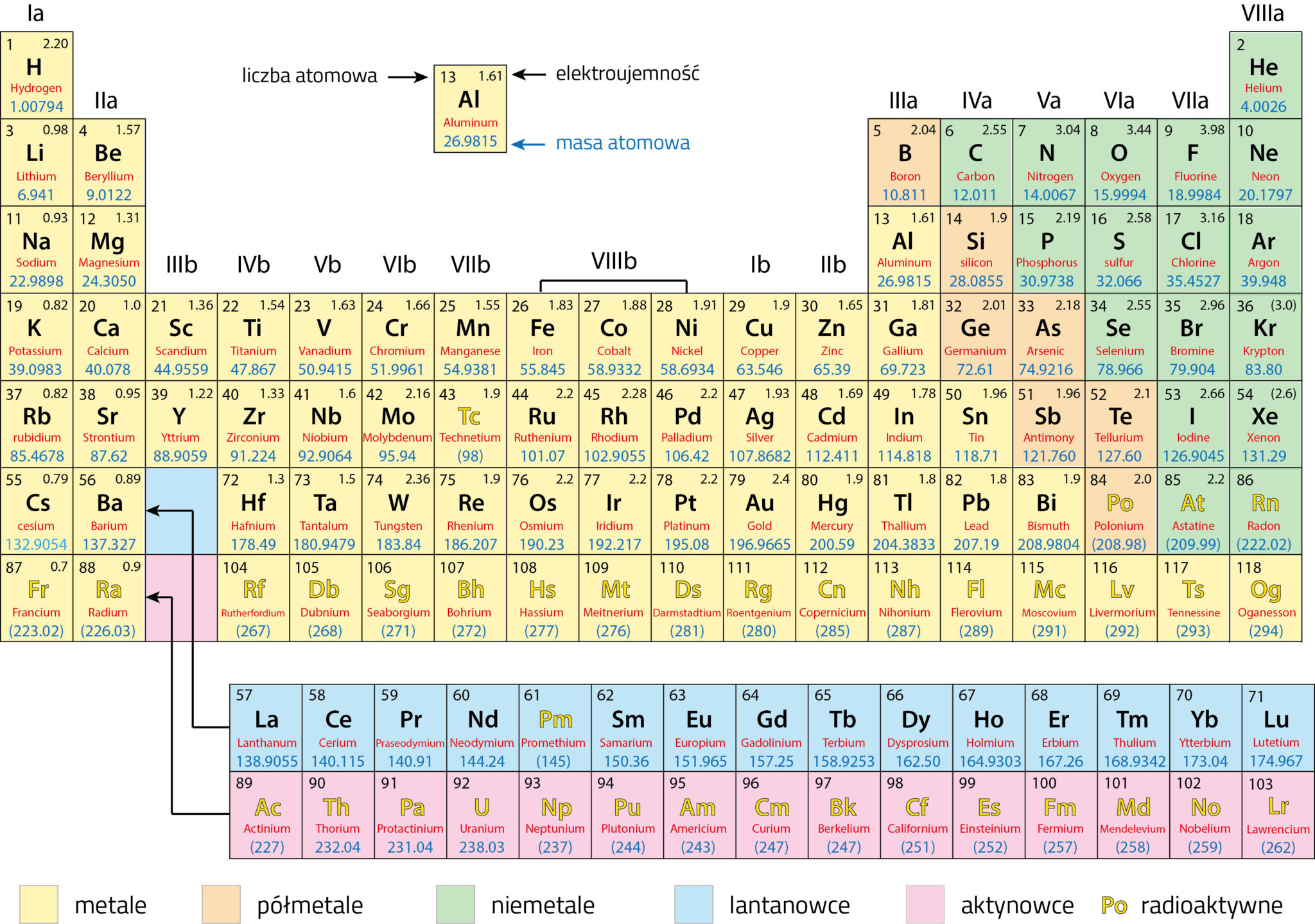
Układ Okresowy Z Liczbami Masowymi
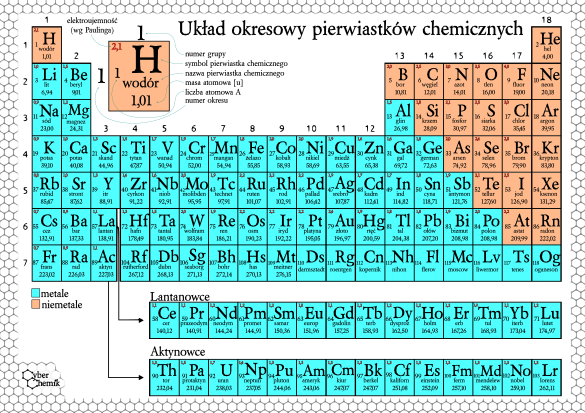
Czy zastanawiałeś się kiedyś, co kryje się za tajemniczymi symbolami w Układzie Okresowym Pierwiastków? Większość z nas kojarzy go z lekcji chemii, gdzie był przedstawiany jako kolorowa tablica z dziwnymi skrótami. Ale Układ Okresowy to znacznie więcej niż tylko zbiór symboli. To potężne narzędzie, które pozwala nam zrozumieć świat materii na najbardziej fundamentalnym poziomie. W tym artykule przyjrzymy się bliżej jednemu z kluczowych aspektów Układu Okresowego – liczbom masowym – i zrozumiemy, jak te liczby pomagają nam rozszyfrować strukturę atomów.
Czym jest Liczba Masowa?
Zanim zagłębimy się w szczegóły, zdefiniujmy, czym właściwie jest liczba masowa. Liczba masowa (A) to suma liczby protonów i neutronów w jądrze atomu. Innymi słowy, określa ona masę jądra atomowego. Protony i neutrony, zbiorczo nazywane nukleonami, mają zbliżoną masę, dlatego liczba masowa daje nam przybliżone pojęcie o masie całego atomu.
Warto zaznaczyć, że liczba atomowa (Z), która określa liczbę protonów w jądrze, odróżnia dany pierwiastek od innych. W Układzie Okresowym pierwiastki są uszeregowane według rosnącej liczby atomowej. Dla danego pierwiastka, liczba atomowa jest zawsze stała, natomiast liczba masowa może się różnić, co prowadzi do istnienia izotopów.
Izotopy: Odmiany tego samego pierwiastka
Izotopy to atomy tego samego pierwiastka, które mają tę samą liczbę protonów (Z), ale różną liczbę neutronów, a więc różną liczbę masową (A). Na przykład, węgiel (C) ma liczbę atomową 6 (zawsze 6 protonów), ale występuje w różnych izotopach, takich jak węgiel-12 (12C), węgiel-13 (13C) i węgiel-14 (14C). Liczby 12, 13 i 14 to liczby masowe tych izotopów.
Różnice w liczbie neutronów wpływają na właściwości jądra atomowego, a w niektórych przypadkach na stabilność atomu. Niektóre izotopy są stabilne (nie rozpadają się samoistnie), a inne są niestabilne (radioaktywne) i podlegają rozpadowi promieniotwórczemu.
Jak Znaleźć Liczbę Masową w Układzie Okresowym?
Układ Okresowy zwykle zawiera dwie liczby związane z każdym pierwiastkiem: liczbę atomową i masę atomową (względną masę atomową). Masa atomowa jest średnią ważoną mas wszystkich naturalnie występujących izotopów danego pierwiastka, uwzględniającą ich względną obfitość. Nie jest to liczba masowa! Liczba masowa jest wartością całkowitą, odnoszącą się do konkretnego izotopu.
Aby znaleźć liczbę masową konkretnego izotopu, musimy znać jego zapis izotopowy (np. 14C) lub informację o liczbie neutronów w jego jądrze. Znając liczbę atomową (liczbę protonów) i liczbę neutronów, możemy obliczyć liczbę masową, dodając te dwie wartości do siebie: A = Z + n (gdzie A to liczba masowa, Z to liczba atomowa, a n to liczba neutronów).
Przykład: Atom tlenu (O) ma liczbę atomową 8. Jeśli mamy izotop tlenu, który ma 8 neutronów, to jego liczba masowa wynosi 8 + 8 = 16. Zatem mamy do czynienia z izotopem tlen-16 (16O).
Znaczenie Liczby Masowej
Liczba masowa, choć na pozór prosta, ma fundamentalne znaczenie w wielu dziedzinach nauki:
- Chemia: Liczba masowa jest istotna przy obliczaniu mas molowych związków chemicznych, co jest niezbędne do przeprowadzania obliczeń stechiometrycznych.
- Fizyka Jądrowa: Liczba masowa odgrywa kluczową rolę w badaniach nad strukturą jądra atomowego, reakcjami jądrowymi i stabilnością izotopów.
- Geochronologia: Analiza proporcji różnych izotopów w skałach i minerałach pozwala na datowanie próbek geologicznych i określanie wieku Ziemi. Metody datowania radiowęglowego (wykorzystujące izotop węgla-14) są szeroko stosowane w archeologii i paleontologii.
- Medycyna: Izotopy promieniotwórcze, o określonych liczbach masowych, są wykorzystywane w diagnostyce medycznej (np. scyntygrafia) i terapii (np. radioterapia).
Wyobraź sobie, że badasz skamieniałość. Analizując proporcje izotopów węgla, naukowcy mogą oszacować, jak dawno temu dany organizm żył. Albo pomyśl o leczeniu raka – promieniowanie emitowane przez radioaktywne izotopy, starannie dobrane ze względu na ich liczbę masową i sposób rozpadu, może niszczyć komórki nowotworowe.
Liczba Masowa a Masa Atomowa: Kluczowe Różnice
Ważne jest, aby odróżnić liczbę masową od masy atomowej (nazywanej też względną masą atomową). Oto kluczowe różnice:
- Liczba masowa (A):
- Jest liczbą całkowitą.
- Określa liczbę nukleonów (protonów i neutronów) w konkretnym izotopie.
- Nie posiada jednostki.
- Masa atomowa (względna masa atomowa):
- Jest liczbą ułamkową (wyrażoną z dokładnością do kilku miejsc po przecinku).
- Jest średnią ważoną mas wszystkich naturalnie występujących izotopów danego pierwiastka, uwzględniającą ich obfitość.
- Wyrażana jest w jednostkach masy atomowej (u) lub jest bezwymiarowa (względna).
Masa atomowa podana w Układzie Okresowym jest niezwykle użyteczna, ponieważ odzwierciedla naturalny skład izotopowy danego pierwiastka. Jednak nie informuje nas bezpośrednio o liczbie neutronów w jądrze konkretnego atomu.
Przykłady Zastosowań w Życiu Codziennym
Chociaż liczby masowe mogą wydawać się abstrakcyjne, mają realny wpływ na nasze życie. Oto kilka przykładów:
- Datowanie radiowęglowe: Archeolodzy wykorzystują izotop węgla-14 (14C) do określania wieku starożytnych artefaktów organicznych. Wiedza o liczbie masowej węgla-14 i jego okresie półtrwania jest kluczowa dla tej metody.
- Diagnostyka medyczna: Izotopy promieniotwórcze, takie jak technet-99m (99mTc), są używane w scyntygrafii do obrazowania narządów wewnętrznych. Liczba masowa tych izotopów wpływa na ich właściwości i bezpieczeństwo stosowania.
- Energetyka jądrowa: Uran-235 (235U) jest wykorzystywany jako paliwo w reaktorach jądrowych. Proces rozszczepienia jądra uranu-235, związany z jego liczbą masową i strukturą jądra, generuje ogromne ilości energii.
- Żywność i rolnictwo: Izotopy stabilne (niepromieniotwórcze), takie jak azot-15 (15N), są używane w rolnictwie do śledzenia obiegu azotu w glebie i roślinach, co pomaga optymalizować nawożenie.
Podsumowanie
Liczba masowa, choć często pomijana, jest fundamentalną cechą atomu, która dostarcza nam cennych informacji o jego strukturze i właściwościach. Zrozumienie liczby masowej i jej związku z liczbą atomową oraz izotopami pozwala nam głębiej zrozumieć Układ Okresowy Pierwiastków i jego liczne zastosowania w nauce, technologii i medycynie. Mamy nadzieję, że ten artykuł pomógł Ci rozszyfrować tę ważną koncepcję i spojrzeć na Układ Okresowy z nowej perspektywy. Pamiętaj, że chemia to nie tylko trudne wzory, ale fascynujący świat, który czeka na odkrycie!