Typy Reakcji Chemicznych Klasa 7
Witajcie, drodzy uczniowie klasy 7! Świat chemii jest fascynujący i pełen niespodzianek. Dzisiaj zgłębimy jeden z jego fundamentów: typy reakcji chemicznych. Zrozumienie tych reakcji to klucz do rozszyfrowania procesów zachodzących wokół nas, od gotowania obiadu po funkcjonowanie naszego organizmu.
Co to jest reakcja chemiczna?
Zanim przejdziemy do typów reakcji, przypomnijmy sobie, czym w ogóle jest reakcja chemiczna. Najprościej mówiąc, to proces, w którym jedne substancje (substraty) przekształcają się w inne (produkty). Zmiana ta wiąże się z przegrupowaniem atomów i przerwaniem lub powstaniem wiązań chemicznych.
Wskaźniki reakcji chemicznej
Jak rozpoznać, że w ogóle zaszła jakaś reakcja? Istnieje kilka charakterystycznych wskaźników:
- Zmiana barwy: Na przykład, wrzucenie kawałka magnezu do kwasu solnego powoduje powstawanie bezbarwnego roztworu, ale samo magnez znika, a powstaje gaz.
- Wydzielanie gazu: Jak wspomniano wyżej, powstawanie pęcherzyków gazu.
- Powstawanie osadu: Mieszanie dwóch klarownych roztworów, które w wyniku reakcji tworzą nierozpuszczalną substancję, czyli osad.
- Zmiana temperatury: Reakcje mogą wydzielać ciepło (reakcje egzotermiczne) lub je pochłaniać (reakcje endotermiczne).
- Wydzielanie światła: Niekiedy reakcjom towarzyszy emisja światła, jak w przypadku spalania.
Główne typy reakcji chemicznych
Teraz przejdźmy do najważniejszego: klasyfikacji reakcji chemicznych. W klasie 7 zazwyczaj poznajemy cztery główne typy:
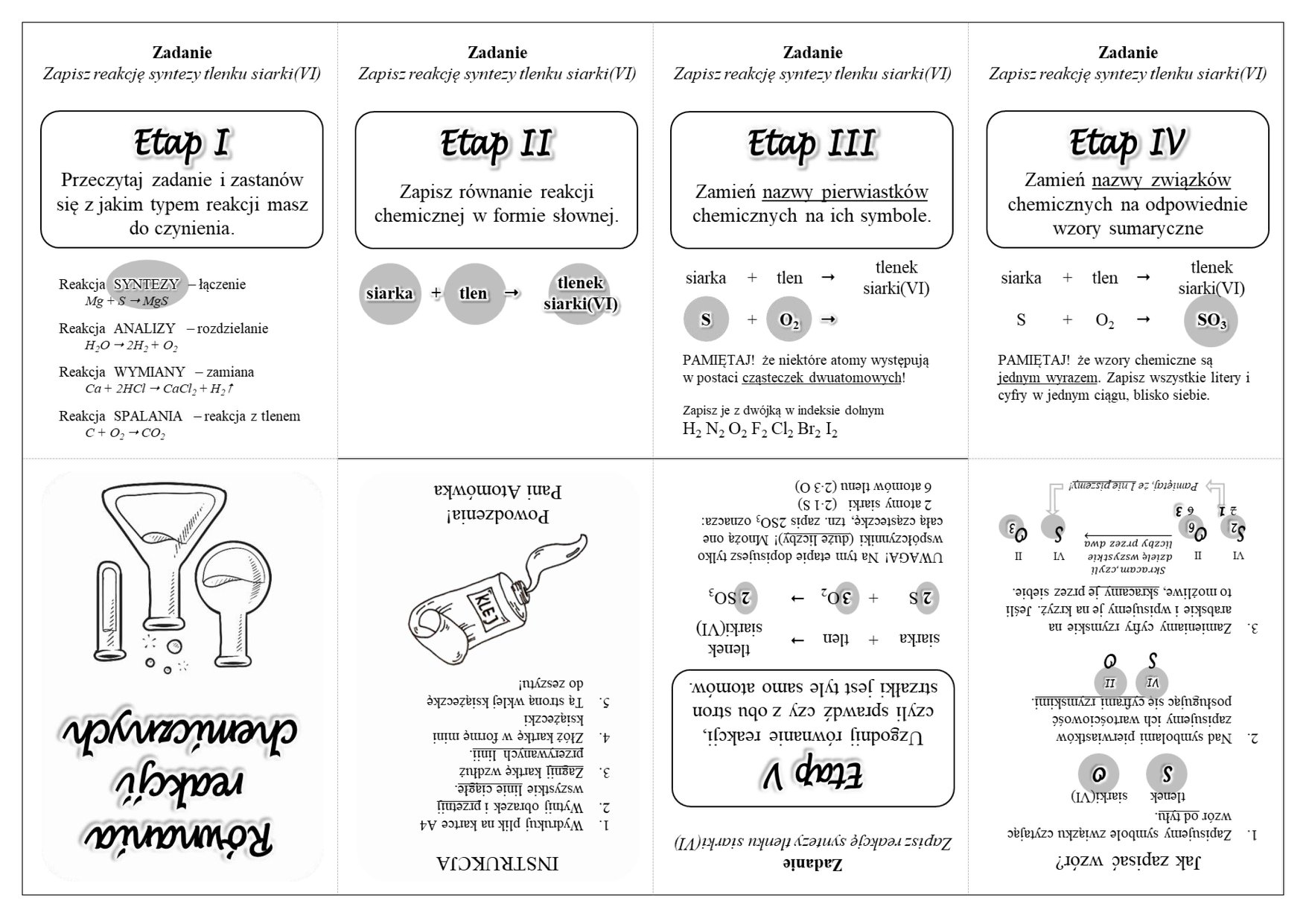
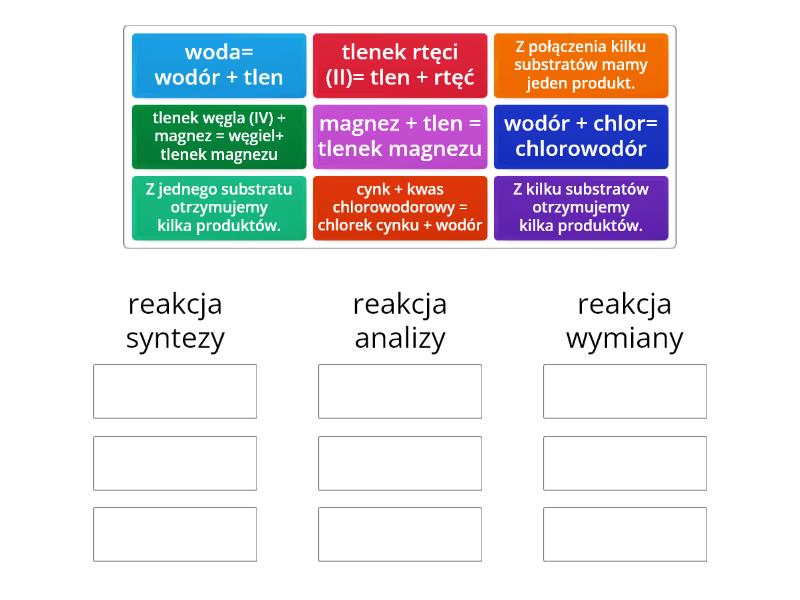
1. Reakcja syntezy (łączenia)
Reakcja syntezy, zwana też reakcją łączenia, to proces, w którym dwie lub więcej substancji łączą się, tworząc jedną, bardziej złożoną substancję.
Ogólny zapis: A + B → AB
Przykład: Łączenie żelaza z siarką w celu utworzenia siarczku żelaza(II):
Fe + S → FeS
Inny przykład to łączenie wodoru z tlenem, tworząc wodę:
2H2 + O2 → 2H2O
Pamiętaj, że w reakcji syntezy liczba produktów jest mniejsza niż liczba substratów.
2. Reakcja analizy (rozkładu)
Reakcja analizy, zwana też reakcją rozkładu, to proces odwrotny do syntezy. Jedna, bardziej złożona substancja rozpada się na dwie lub więcej prostszych substancji.
Ogólny zapis: AB → A + B
Przykład: Rozkład tlenku rtęci(II) pod wpływem wysokiej temperatury na rtęć i tlen:
2HgO → 2Hg + O2
Elektroliza wody (rozkład wody na wodór i tlen pod wpływem prądu elektrycznego) jest kolejnym przykładem:
2H2O → 2H2 + O2
W reakcji analizy liczba produktów jest większa niż liczba substratów.
3. Reakcja wymiany pojedynczej (substytucji)
Reakcja wymiany pojedynczej, zwana też reakcją substytucji, to proces, w którym jeden atom lub grupa atomów w związku chemicznym jest zastępowana przez inny atom lub grupę atomów.
Ogólny zapis: A + BC → AC + B
Przykład: Reakcja cynku z kwasem solnym. Cynk wypiera wodór z kwasu, tworząc chlorek cynku:
Zn + 2HCl → ZnCl2 + H2
Inny przykład to wypieranie miedzi przez żelazo z roztworu siarczanu miedzi(II). Żelazo reaguje z siarczanem miedzi(II), tworząc siarczan żelaza(II) i wydzielając miedź:
Fe + CuSO4 → FeSO4 + Cu
Zwróć uwagę, że aktywność metali ma znaczenie w reakcjach wymiany pojedynczej. Metal bardziej aktywny wypiera metal mniej aktywny z roztworu jego soli.
4. Reakcja wymiany podwójnej (metatezy)
Reakcja wymiany podwójnej, zwana też reakcją metatezy, to proces, w którym dwa związki chemiczne wymieniają się swoimi jonami.
Ogólny zapis: AB + CD → AD + CB
Przykład: Reakcja azotanu srebra z chlorkiem sodu. Srebro łączy się z chlorkiem, tworząc nierozpuszczalny chlorek srebra (osad), a sód łączy się z azotanem, tworząc azotan sodu:
AgNO3 + NaCl → AgCl↓ + NaNO3
Powstawanie osadu jest częstym motorem napędowym dla tego typu reakcji. Innym przykładem jest reakcja kwasu solnego z wodorotlenkiem sodu (reakcja zobojętniania):
HCl + NaOH → NaCl + H2O
W tym przypadku powstaje woda, co również jest "motorem" reakcji.
Równania reakcji chemicznych
Równanie reakcji chemicznej to zapis symboliczny, który opisuje przebieg reakcji. Musi być ono uzgodnione, czyli liczba atomów każdego pierwiastka po stronie substratów musi być równa liczbie atomów tego samego pierwiastka po stronie produktów. Uzgadnianie równań reakcji polega na dobieraniu odpowiednich współczynników stechiometrycznych przed symbolami i wzorami chemicznymi.
Przykład: Nieuzgodnione równanie spalania metanu:
CH4 + O2 → CO2 + H2O
Uzgondnione równanie:
CH4 + 2O2 → CO2 + 2H2O
Teraz po obu stronach równania mamy 1 atom węgla, 4 atomy wodoru i 4 atomy tlenu.
Reakcje redoks (utleniania-redukcji) - krótka wzmianka
Oprócz wymienionych typów reakcji, istnieje jeszcze jedna bardzo ważna kategoria: reakcje redoks, czyli reakcje utleniania-redukcji. W tych reakcjach następuje przeniesienie elektronów między substancjami. Jedna substancja utlenia się (traci elektrony), a druga redukuje się (zyskuje elektrony). Spalanie, korozja metali, procesy zachodzące w ogniwach galwanicznych – to tylko niektóre przykłady reakcji redoks.
Choć szczegółowe omawianie reakcji redoks wykracza poza program klasy 7, warto wiedzieć o ich istnieniu.
Przykłady z życia codziennego
Reakcje chemiczne towarzyszą nam na każdym kroku. Oto kilka przykładów:
- Spalanie gazu w kuchence: To reakcja utleniania (redoks), w której gaz (np. metan) reaguje z tlenem, wydzielając ciepło i światło.
- Rdzewienie żelaza: Kolejna reakcja utleniania (redoks), w której żelazo reaguje z tlenem i wodą, tworząc rdzę.
- Trawienie pokarmu: Wiele reakcji chemicznych zachodzi w naszym układzie pokarmowym, rozkładając złożone cząsteczki na prostsze, które organizm może przyswoić. Enzymy pełnią rolę katalizatorów tych reakcji.
- Fotosynteza: Rośliny wykorzystują energię słoneczną do syntezy glukozy z dwutlenku węgla i wody.
- Mieszanie octu z sodą oczyszczoną: Powstaje burzliwa reakcja z wydzielaniem gazu (dwutlenku węgla). Jest to reakcja wymiany podwójnej, w której powstaje sól (octan sodu) i kwas węglowy, który rozkłada się na wodę i dwutlenek węgla.
Podsumowanie i co dalej?
Mam nadzieję, że po przeczytaniu tego artykułu lepiej rozumiecie podstawowe typy reakcji chemicznych. Pamiętajcie, że kluczem do sukcesu jest ćwiczenie! Rozwiązujcie zadania, analizujcie różne reakcje i próbujcie je zaklasyfikować. Z czasem stanie się to dla Was naturalne. Spróbujcie poszukać przykładów reakcji chemicznych w swoim otoczeniu i spróbujcie je zidentyfikować. Pamiętajcie też o równaniach reakcji – uzgadnianie ich jest bardzo ważne!
Powodzenia w dalszej nauce chemii! To fascynująca dziedzina, która otwiera drzwi do zrozumienia świata!