To Jest Chemia 2 Sprawdzian Alkohole I Fenole

Niniejszy artykuł ma na celu kompleksowe omówienie zagadnień związanych z alkoholami i fenolami, szczególnie w kontekście materiału obowiązującego na sprawdzianie z chemii (np. "To Jest Chemia 2"). Zrozumienie struktury, właściwości oraz reakcji tych grup związków organicznych jest kluczowe do poprawnego rozwiązywania zadań i zrozumienia bardziej zaawansowanych tematów chemicznych.
Alkohole: Struktura, Nomenklatura i Właściwości
Struktura i Nomenklatura
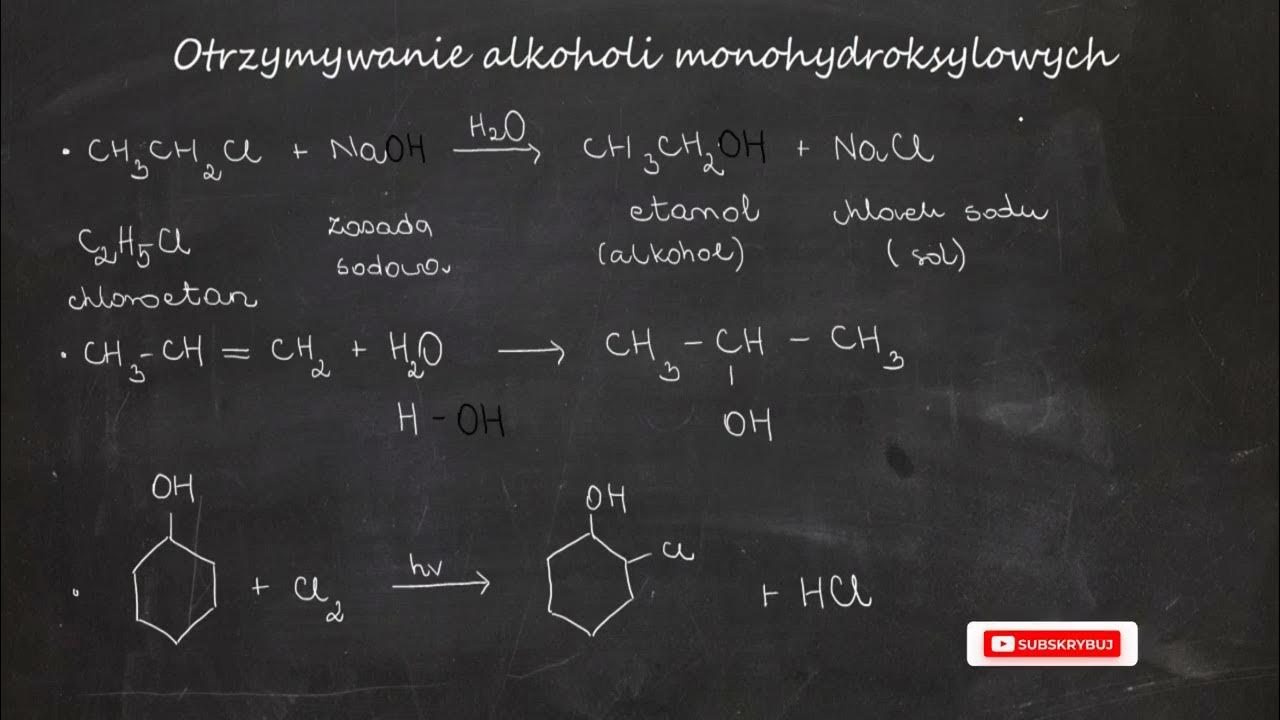
Alkohole to związki organiczne, które w swojej strukturze zawierają grupę hydroksylową (-OH) połączoną z atomem węgla. Klasyfikacja alkoholi opiera się na rzędowości atomu węgla, do którego przyłączona jest grupa -OH. Wyróżniamy zatem alkohole pierwszorzędowe (1°), drugorzędowe (2°) i trzeciorzędowe (3°). Nomenklatura systematyczna alkoholi opiera się na dodaniu końcówki "-ol" do nazwy macierzystego węglowodoru. Przykładowo, CH3OH to metanol, a CH3CH2OH to etanol.
Ważne jest, aby pamiętać o numerowaniu atomów węgla w łańcuchu głównym tak, aby lokant grupy -OH miał jak najniższy numer. Dla alkoholi cyklicznych, grupa -OH przyjmuje numer 1, a numeracja pozostałych atomów węgla odbywa się tak, aby podstawniki miały najniższe możliwe numery.
Właściwości Fizyczne
Obecność grupy hydroksylowej wpływa znacząco na właściwości fizyczne alkoholi. Grupa -OH jest polarna i zdolna do tworzenia wiązań wodorowych. W związku z tym, alkohole charakteryzują się wyższymi temperaturami wrzenia niż odpowiadające im węglowodory. Rozpuszczalność alkoholi w wodzie zależy od długości łańcucha węglowodorowego. Krótkołańcuchowe alkohole (np. metanol, etanol, propanol) są mieszalne z wodą w każdym stosunku, natomiast rozpuszczalność alkoholi o dłuższych łańcuchach maleje wraz ze wzrostem liczby atomów węgla.
Właściwości Chemiczne i Reakcje
Alkohole ulegają różnym reakcjom chemicznym, w tym:
- Utlenianiu: Alkohole pierwszorzędowe utleniają się do aldehydów, a następnie do kwasów karboksylowych. Alkohole drugorzędowe utleniają się do ketonów. Alkohole trzeciorzędowe są oporne na utlenianie w łagodnych warunkach.
- Odwodnieniu: W obecności kwasu i pod wpływem temperatury, alkohole mogą ulegać odwodnieniu, tworząc alkeny.
- Estryfikacji: Reakcja alkoholu z kwasem karboksylowym prowadzi do powstania estru i wody.
- Reakcji z metalami aktywnymi: Alkohole reagują z metalami aktywnymi, takimi jak sód i potas, tworząc alkoholany i wydzielając wodór.
Fenole: Struktura, Nomenklatura i Właściwości
Struktura i Nomenklatura
Fenole to związki organiczne, w których grupa hydroksylowa (-OH) jest bezpośrednio połączona z atomem węgla w pierścieniu aromatycznym (benzenowym). Najprostszym fenolem jest fenol (C6H5OH). Nomenklatura fenoli opiera się na numerowaniu atomów węgla w pierścieniu benzenowym, przy czym atom węgla związany z grupą -OH ma numer 1. Podstawniki w pierścieniu benzenowym określa się za pomocą lokantów i nazw. Istnieją również nazwy zwyczajowe dla niektórych fenoli, np. krezole (metylofenole) i rezorcyna (1,3-dihydroksybenzen).
Właściwości Fizyczne
Fenole są zazwyczaj ciałami stałymi o charakterystycznym zapachu. Podobnie jak alkohole, fenole są zdolne do tworzenia wiązań wodorowych. Jednak, ze względu na większy charakter hydrofobowy pierścienia aromatycznego, rozpuszczalność fenoli w wodzie jest zazwyczaj niższa niż alkoholi o podobnej masie cząsteczkowej. Temperatury wrzenia fenoli są również wyższe niż odpowiadających im aromatycznych węglowodorów.
Właściwości Chemiczne i Reakcje
Fenole wykazują pewne podobieństwa i różnice w porównaniu z alkoholami pod względem właściwości chemicznych. Charakterystyczne reakcje fenoli to:
- Kwasowość: Fenole są słabszymi kwasami niż kwasy karboksylowe, ale silniejszymi kwasami niż alkohole. Jon fenolanowy (powstający po oddysocjowaniu protonu z grupy -OH) jest stabilizowany przez rezonans w pierścieniu aromatycznym.
- Reakcje substytucji elektrofilowej: Pierścień benzenowy w fenolach jest bardziej reaktywny w reakcjach substytucji elektrofilowej niż benzen. Grupa -OH jest aktywatorem i kieruje podstawniki w pozycje orto i para.
- Reakcja z chlorkiem żelaza(III): Fenole reagują z chlorkiem żelaza(III), tworząc barwne kompleksy. Reakcja ta służy do identyfikacji fenoli.
Przykłady Zastosowań Alkoholów i Fenoli
Alkohole i fenole znajdują szerokie zastosowanie w różnych dziedzinach:
- Etanol: Stosowany jako rozpuszczalnik, składnik napojów alkoholowych, paliwo, środek dezynfekcyjny.
- Metanol: Stosowany jako rozpuszczalnik, surowiec do produkcji formaldehydu.
- Glikol etylenowy: Stosowany jako składnik płynów chłodniczych.
- Glicerol: Stosowany w kosmetykach, farmacji, przemyśle spożywczym.
- Fenol: Stosowany do produkcji żywic fenolowo-formaldehydowych, nylonu, leków.
- Krezole: Stosowane jako środki dezynfekcyjne, konserwanty drewna.
Podsumowanie
Zarówno alkohole, jak i fenole to istotne związki organiczne o szerokim spektrum zastosowań. Zrozumienie ich struktury, właściwości i reakcji chemicznych jest niezbędne do opanowania materiału z chemii organicznej. Przygotowując się do sprawdzianu, warto skupić się na różnicach i podobieństwach pomiędzy alkoholami i fenolami, a także na charakterystycznych dla nich reakcjach.
Powodzenia na sprawdzianie! Pamiętaj o dokładnym przestudiowaniu notatek i rozwiązywaniu zadań. Ćwiczenie czyni mistrza!