Tlenki Wodorotlenki Kwasy Sole Liceum

Chemia licealna to często dla wielu osób labirynt wzorów i reakcji. Ale nie bój się! Dziś postaramy się uprościć temat tlenków, wodorotlenków, kwasów i soli, skupiając się na tym, co najważniejsze i używając porównań, które pomogą Ci zrozumieć te zagadnienia.
Tlenki: Powietrze, rdza i więcej
Zacznijmy od tlenków. Najprościej mówiąc, tlenek to związek chemiczny, który zawiera tlen (O) i inny pierwiastek chemiczny. Wyobraź sobie, że tlen to bardzo towarzyski pierwiastek, który lubi łączyć się z innymi. Tlenki są dosłownie wszędzie!
Przykłady:
- Woda (H2O) – tak, woda to tlenek wodoru! To podstawowy tlenek niezbędny do życia. Wyobraź sobie wodę jako parę przyjaciół (dwóch atomów wodoru) trzymających się za rękę z atomem tlenu.
- Dwutlenek węgla (CO2) – wydychamy go, powstaje podczas spalania. To atom węgla z dwoma atomami tlenu. Rośliny używają go w procesie fotosyntezy.
- Tlenek żelaza (Fe2O3) – czyli rdza! Kiedy żelazo reaguje z tlenem w obecności wilgoci, powstaje ten tlenek. Pomyśl o rdzewiejącym rowerze – to tlenek w akcji.
Jak to zapamiętać? Pomyśl o tlenie jako o podstawie słowa "tlenek". Cokolwiek łączy się z tlenem, tworzy tlenek!
Podział tlenków: Tlenki dzielimy na różne kategorie w zależności od ich właściwości chemicznych, na przykład:
- Tlenki kwasowe: Reagują z wodą, tworząc kwasy (np. SO2).
- Tlenki zasadowe: Reagują z wodą, tworząc zasady (wodorotlenki – o tym za chwilę!) np. Na2O.
- Tlenki obojętne: Nie reagują ani z kwasami, ani z zasadami (np. CO).
- Tlenki amfoteryczne: Reagują zarówno z kwasami, jak i zasadami (np. Al2O3).
Wodorotlenki: Gorzkie zasady
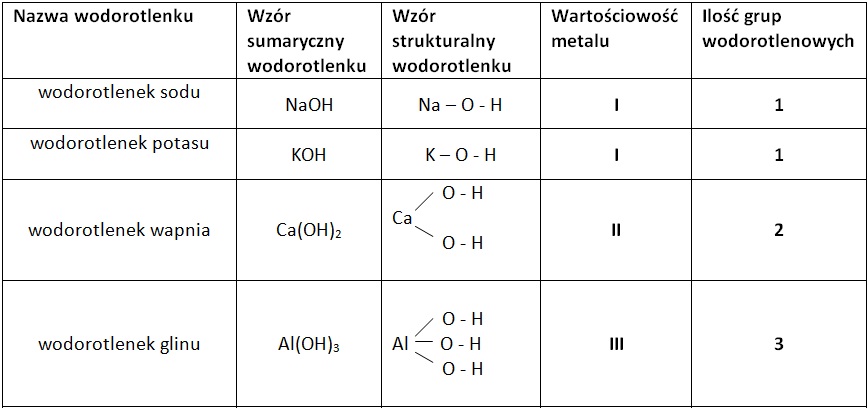
Teraz przejdźmy do wodorotlenków. Wodorotlenek to związek chemiczny, który zawiera metal (najczęściej z grup 1 i 2 układu okresowego) połączony z grupą wodorotlenową (OH-). Grupa wodorotlenowa to taka "ekipa" składająca się z atomu tlenu i atomu wodoru, która razem działa jako całość.
Przykłady:
- Wodorotlenek sodu (NaOH) – znany również jako soda kaustyczna. Używany do udrażniania rur. UWAGA: Jest żrący i trzeba uważać! Wyobraź sobie, że jest to "odkurzacz" do rur, ale bardzo silny.
- Wodorotlenek potasu (KOH) – używany w mydłach w płynie.
- Wodorotlenek wapnia (Ca(OH)2) – czyli wapno gaszone. Używany w budownictwie.
Jak to zapamiętać? Wodorotlenek zawsze ma w swojej formule "OH". To jest znak rozpoznawczy! Metale + OH = Wodorotlenek.
Wodorotlenki to zasady. Oznacza to, że mają odczyn zasadowy i reagują z kwasami (o tym za chwilę!). Zasady często mają gorzki smak (ale nigdy ich nie próbuj!), a ich roztwory mydlą w dotyku. Pamiętaj o skali pH – zasady mają pH powyżej 7.
Kwasy: Kwaśne smaki i siła
Kolejna grupa to kwasy. Kwasy to związki chemiczne, które mają odczyn kwaśny. Definicja kwasu zależy od teorii, ale najprościej: kwasy zawierają atomy wodoru (H), które mogą oddawać w reakcjach chemicznych. Kwasy mają pH poniżej 7.
Przykłady:
- Kwas solny (HCl) – obecny w żołądku, pomaga trawić pokarm. Wyobraź sobie go jako "niszczyciela" jedzenia na mniejsze kawałki.
- Kwas siarkowy (H2SO4) – używany w przemyśle, np. do produkcji nawozów. To bardzo silny kwas.
- Kwas octowy (CH3COOH) – obecny w occie. Dzięki niemu sałatka ma kwaśny smak.
- Kwas cytrynowy (C6H8O7) – w cytrynach i innych owocach. Nadaje im kwaśny smak.
Jak to zapamiętać? Kwasy często zaczynają się od "H" (ale nie zawsze!). Myśl o nich jako o "kwasidłach", które mają kwaśny smak. UWAGA: Nie próbuj kwasów laboratoryjnych! Są żrące!
Kwasy dzielimy na mocne i słabe. Mocne kwasy (np. HCl, H2SO4) w roztworach wodnych ulegają całkowitej dysocjacji (rozpadają się na jony). Słabe kwasy (np. CH3COOH) dysocjują tylko częściowo.
Sole: Neutralizacja i kryształy
Ostatnią grupą są sole. Sole powstają w wyniku reakcji neutralizacji, czyli reakcji kwasu z zasadą (wodorotlenkiem). Kwas i zasada "walczą" ze sobą, a efektem jest sól i woda. Pomyśl o tym jak o dwóch wrogach, którzy się godzą i tworzą coś nowego.
Przykłady:
- Chlorek sodu (NaCl) – sól kuchenna! Używamy jej do przyprawiania potraw. Powstaje w reakcji kwasu solnego (HCl) z wodorotlenkiem sodu (NaOH).
- Węglan wapnia (CaCO3) – składnik wapieni, marmuru i kredy.
- Siarczan magnezu (MgSO4) – sól Epsom, używana do kąpieli relaksacyjnych.
Jak to zapamiętać? Sól to wynik "pogodzenia się" kwasu i zasady. Sól składa się z kationu (jonu dodatniego) pochodzącego od zasady (najczęściej metalu) i anionu (jonu ujemnego) pochodzącego od kwasu.
Sole mają różne zastosowania – w przemyśle, rolnictwie, medycynie i oczywiście w kuchni. Wiele soli tworzy piękne kryształy, co możesz zaobserwować, rozpuszczając sól kuchenną w wodzie i pozwalając jej powoli parować.
Mam nadzieję, że teraz tlenki, wodorotlenki, kwasy i sole wydają się mniej straszne. Pamiętaj o przykładach, porównaniach i wizualizacjach, a chemia stanie się o wiele łatwiejsza!