Tlenki Metali I Niemetali Prezentacja
Hej Studenci! Zbliża się egzamin z chemii, a konkretnie z tlenków metali i niemetali? Bez obaw! Przygotowałem dla Was ten szczegółowy przewodnik, który pomoże Wam usystematyzować wiedzę i podejść do egzaminu z pewnością siebie. Pamiętajcie, chemia to nie magia – to logiczne zależności! Damy radę!
Wprowadzenie do Tlenków
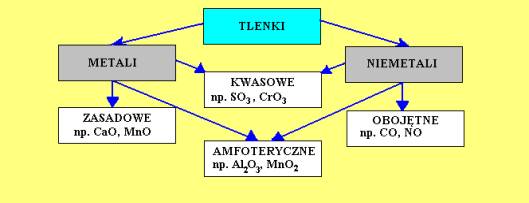
Zacznijmy od podstaw. Tlenki to związki chemiczne, które powstają w wyniku połączenia tlenu z innym pierwiastkiem. Bardzo ważne jest, żeby pamiętać, że tlen musi być bardziej elektroujemny od tego drugiego pierwiastka. Możemy je podzielić na dwie główne kategorie:
- Tlenki metali
- Tlenki niemetali
Różnią się one właściwościami i sposobem reakcji, dlatego ważne jest, żeby dobrze je rozróżniać.
Tlenki Metali
Tlenki metali, jak sama nazwa wskazuje, powstają w wyniku reakcji tlenu z metalem. Generalnie, tlenki metali charakteryzują się właściwościami zasadowymi. To oznacza, że reagują z kwasami, tworząc sole i wodę. Ale uwaga! Nie wszystkie tlenki metali reagują bezpośrednio z wodą, tworząc zasady. Te, które reagują, tworzą wodorotlenki (zasady). Na przykład:
Na2O + H2O → 2NaOH (Tlenek sodu reaguje z wodą, tworząc wodorotlenek sodu)
Wiele tlenków metali, szczególnie tych o niskich stopniach utlenienia, ma charakter zasadowy. Jednak niektóre metale, zwłaszcza te o wyższych stopniach utlenienia, mogą tworzyć tlenki o charakterze amfoterycznym. Tlenki amfoteryczne reagują zarówno z kwasami, jak i z zasadami.
Przykładem metalu tworzącego tlenki o charakterze amfoterycznym jest glin. Al2O3 (tlenek glinu) może reagować zarówno z kwasem chlorowodorowym (HCl), jak i z wodorotlenkiem sodu (NaOH).
Tlenki Niemetali
Tlenki niemetali powstają w wyniku reakcji tlenu z niemetalem. W przeciwieństwie do tlenków metali, tlenki niemetali zazwyczaj mają właściwości kwasowe. Oznacza to, że reagują z zasadami, tworząc sole i wodę. Kiedy tlenek niemetalu reaguje z wodą, tworzy kwas. Na przykład:
SO2 + H2O → H2SO3 (Dwutlenek siarki reaguje z wodą, tworząc kwas siarkawy)
Warto zapamiętać kilka popularnych tlenków niemetali i odpowiadające im kwasy:
- CO2 (dwutlenek węgla) → H2CO3 (kwas węglowy)
- SO3 (trójtlenek siarki) → H2SO4 (kwas siarkowy)
- P2O5 (tlenek fosforu(V)) → H3PO4 (kwas ortofosforowy(V))
Podobnie jak w przypadku metali, niektóre niemetale mogą tworzyć tlenki o różnych charakterach w zależności od stopnia utlenienia. Na przykład, tlenek azotu(II) (NO) jest obojętny.
Nomenklatura Tlenków
Nazewnictwo tlenków jest dość proste. Używamy słowa "tlenek" i dodajemy nazwę pierwiastka, z którym tlen się połączył. Jeśli pierwiastek może tworzyć różne tlenki (ma różne stopnie utlenienia), dodajemy w nawiasie cyfrę rzymską oznaczającą stopień utlenienia pierwiastka.
Przykłady:
- FeO - Tlenek żelaza(II)
- Fe2O3 - Tlenek żelaza(III)
- CO - Tlenek węgla(II) (czad)
- CO2 - Tlenek węgla(IV) (dwutlenek węgla)
Pamiętaj, żeby obliczyć stopień utlenienia pierwiastka, korzystając z tego, że tlen w tlenkach ma zazwyczaj stopień utlenienia -II.
Właściwości Fizyczne i Chemiczne
Właściwości tlenków są bardzo zróżnicowane i zależą od rodzaju pierwiastka, który połączył się z tlenem. Tlenki metali często są ciałami stałymi o wysokich temperaturach topnienia. Tlenki niemetali mogą występować w różnych stanach skupienia – jako gazy (np. CO2), ciecze (np. H2O) lub ciała stałe (np. SiO2).
Reaktywność tlenków również jest różna. Ważne jest, żeby pamiętać o reakcjach:
- Reakcje z wodą: Tlenki metali tworzą wodorotlenki (zasady), a tlenki niemetali tworzą kwasy (często!).
- Reakcje z kwasami i zasadami: Tlenki zasadowe reagują z kwasami, tlenki kwasowe reagują z zasadami, a tlenki amfoteryczne reagują zarówno z kwasami, jak i zasadami.
- Reakcje redoks: Tlenki mogą brać udział w reakcjach utleniania-redukcji, działając jako utleniacze lub reduktory.
Zastosowania Tlenków
Tlenki mają bardzo szerokie zastosowanie w różnych dziedzinach. Oto kilka przykładów:
- Tlenek glinu (Al2O3): Stosowany jako materiał ścierny, w produkcji ceramiki i jako katalizator.
- Tlenek żelaza(III) (Fe2O3): Stosowany jako pigment (rdza), w produkcji farb i w hutnictwie.
- Tlenek krzemu(IV) (SiO2): Główny składnik piasku i kwarcu, stosowany w produkcji szkła, ceramiki i jako materiał izolacyjny.
- Dwutlenek węgla (CO2): Stosowany w napojach gazowanych, jako chłodziwo (suchy lód) i w procesach przemysłowych.
- Tlenek wapnia (CaO): Stosowany w budownictwie (wapno palone), w rolnictwie (do odkwaszania gleby) i w przemyśle chemicznym.
Podsumowanie i Kluczowe Punkty
Brawo! Dotarliśmy do końca tego przewodnika. Aby ułatwić Wam powtórkę, podsumujmy najważniejsze punkty:
- Tlenki to związki tlenu z innymi pierwiastkami.
- Tlenki metali zazwyczaj mają charakter zasadowy (reagują z kwasami). Niektóre są amfoteryczne.
- Tlenki niemetali zazwyczaj mają charakter kwasowy (reagują z zasadami).
- Pamiętaj o nomenklaturze - nazwa "tlenek" + nazwa pierwiastka + stopień utlenienia (jeśli konieczne).
- Zwróć uwagę na reakcje tlenków z wodą, kwasami i zasadami.
- Zapamiętaj przykłady tlenków i ich zastosowania.
Powodzenia na egzaminie! Pamiętajcie, żeby dokładnie czytać pytania i spokojnie analizować reakcje. Jestem przekonany, że dacie z siebie wszystko i osiągniecie świetne wyniki. Trzymam za Was kciuki! Jeśli macie pytania, śmiało piszcie!