Tlenki I Wodorotlenki Klasa 8

Witaj w świecie chemii, a konkretnie w fascynującym królestwie tlenków i wodorotlenków! W klasie 8 zaczynamy poważną przygodę z tymi związkami, które otaczają nas dosłownie wszędzie. Od rdzy na rowerze po składniki pasty do zębów – tlenki i wodorotlenki są kluczowe dla zrozumienia wielu procesów zachodzących w naszym świecie. Przygotuj się na szczegółowe omówienie tych związków, ich właściwości, zastosowań i sposobu powstawania. Postaramy się wyjaśnić to wszystko w sposób jasny i zrozumiały, bez zbędnego upraszczania skomplikowanych zagadnień.
Tlenki: Związki z Tlenem
Tlenki to związki chemiczne, w których tlen łączy się z innym pierwiastkiem. To bardzo szeroka grupa związków, o bardzo różnorodnych właściwościach. Wzór ogólny tlenku to ExOy, gdzie E oznacza dowolny pierwiastek, a x i y to liczby atomów każdego z pierwiastków w cząsteczce.
Powstawanie Tlenków
Tlenki powstają najczęściej w wyniku reakcji spalania, czyli gwałtownego łączenia się substancji z tlenem, któremu towarzyszy wydzielanie ciepła i światła. Przykładem jest spalanie węgla: C + O2 → CO2. Inne metody otrzymywania tlenków to bezpośrednie łączenie pierwiastków z tlenem w podwyższonej temperaturze lub rozkład termiczny niektórych związków.
Rodzaje Tlenków
Ze względu na charakter chemiczny, tlenki dzielimy na:
- Tlenki kwasowe (bezwodniki kwasowe): Reagują z zasadami, tworząc sole i wodę. Przykładem jest dwutlenek siarki (SO2), który reaguje z wodą, tworząc kwas siarkowy(IV).
- Tlenki zasadowe: Reagują z kwasami, tworząc sole i wodę. Przykładem jest tlenek sodu (Na2O), który reaguje z kwasem solnym (HCl), tworząc chlorek sodu (NaCl) i wodę.
- Tlenki amfoteryczne: Reagują zarówno z kwasami, jak i z zasadami, wykazując cechy zarówno kwasowe, jak i zasadowe. Przykładem jest tlenek glinu (Al2O3).
- Tlenki obojętne: Nie reagują ani z kwasami, ani z zasadami. Przykładem jest tlenek węgla(II) (CO).
Bardzo ważne jest zrozumienie, że charakter chemiczny tlenku zależy od elektroujemności pierwiastka, który łączy się z tlenem. Pierwiastki o niskiej elektroujemności (metale) tworzą tlenki zasadowe, a pierwiastki o wysokiej elektroujemności (niemetale) tworzą tlenki kwasowe.
Nazywanie Tlenków
Nazwa tlenku składa się z wyrazu "tlenek" oraz nazwy pierwiastka, który łączy się z tlenem. Jeśli pierwiastek tworzy kilka tlenków, konieczne jest podanie jego wartościowości w nawiasie rzymską cyfrą. Na przykład: tlenek żelaza(II) (FeO) i tlenek żelaza(III) (Fe2O3).
Przykłady Tlenków i ich Zastosowania
- Dwutlenek węgla (CO2): Powstaje podczas spalania paliw i oddychania. Używany w napojach gazowanych, gaśnicach i procesie fotosyntezy. Jego nadmiar w atmosferze przyczynia się do efektu cieplarnianego.
- Woda (H2O): Niezbędna do życia, rozpuszczalnik, regulator temperatury.
- Tlenek glinu (Al2O3): Składnik korundu (szmergiel), używany jako materiał ścierny i w produkcji ceramiki.
- Tlenek wapnia (CaO) (wapno palone): Używany w budownictwie, rolnictwie i przemyśle chemicznym.
- Tlenek żelaza(III) (Fe2O3) (rdza): Powstaje podczas korozji żelaza. Używany jako pigment.
Wodorotlenki: Związki z Grupą Hydroksylową
Wodorotlenki to związki chemiczne, które zawierają grupę hydroksylową (-OH) połączoną z metalem. Wzór ogólny wodorotlenku to M(OH)n, gdzie M oznacza metal, a n to jego wartościowość. Wodorotlenki są zasadami, czyli związkami, które w roztworach wodnych dysocjują na jony metalu (Mn+) i jony wodorotlenkowe (OH-).
Powstawanie Wodorotlenków
Wodorotlenki powstają najczęściej w wyniku reakcji tlenków metali z wodą. Na przykład: tlenek sodu (Na2O) reaguje z wodą, tworząc wodorotlenek sodu (NaOH): Na2O + H2O → 2NaOH. Innym sposobem jest reakcja metali z wodą, choć niektóre metale (np. sód, potas) reagują bardzo gwałtownie, wydzielając wodór: 2Na + 2H2O → 2NaOH + H2.
Właściwości Wodorotlenków
Wodorotlenki mają charakterystyczne właściwości:
- Odczyn zasadowy: Powodują zmianę barwy wskaźników, np. fenoloftaleina barwi się na malinowo, a papierek wskaźnikowy uniwersalny na niebiesko.
- Śliskie w dotyku: Szczególnie wodorotlenki metali alkalicznych i ziem alkalicznych.
- Żrące: Mogą powodować oparzenia skóry.
- Reagują z kwasami (reakcja zobojętniania): Tworzą sól i wodę.
Podział Wodorotlenków
Wodorotlenki dzielimy na:
- Wodorotlenki rozpuszczalne w wodzie (zasady): Tworzą silne zasady, np. NaOH, KOH, Ca(OH)2.
- Wodorotlenki nierozpuszczalne w wodzie: Tworzą słabe zasady, np. Cu(OH)2, Fe(OH)3.
Rozpuszczalność wodorotlenków w wodzie zależy od rodzaju metalu. Wodorotlenki metali alkalicznych (litowce) są zwykle bardzo dobrze rozpuszczalne, natomiast wodorotlenki metali przejściowych (np. miedzi, żelaza) są praktycznie nierozpuszczalne.
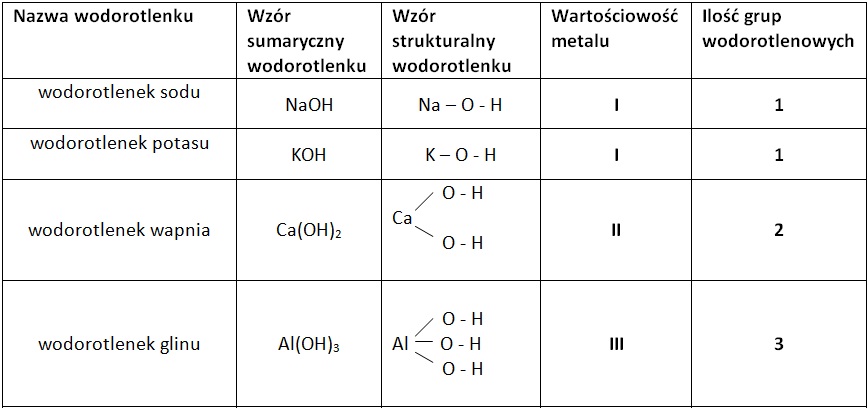
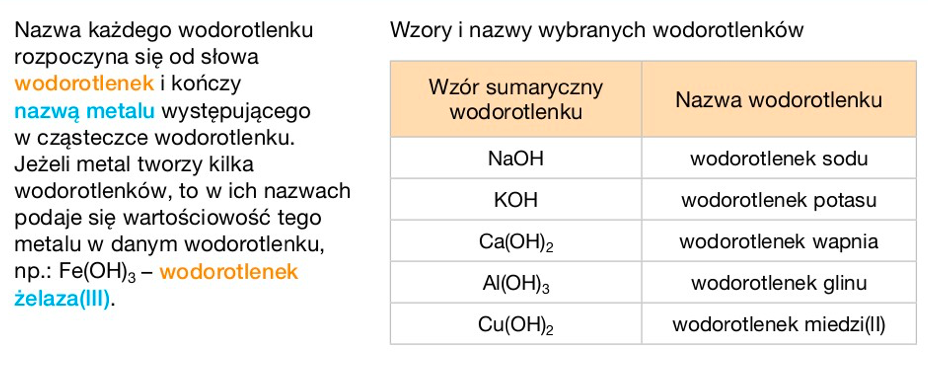
Nazywanie Wodorotlenków
Nazwa wodorotlenku składa się z wyrazu "wodorotlenek" oraz nazwy metalu. Jeśli metal tworzy kilka wodorotlenków, konieczne jest podanie jego wartościowości w nawiasie rzymską cyfrą. Na przykład: wodorotlenek żelaza(II) (Fe(OH)2) i wodorotlenek żelaza(III) (Fe(OH)3).
Przykłady Wodorotlenków i ich Zastosowania
- Wodorotlenek sodu (NaOH) (soda kaustyczna): Używany w przemyśle chemicznym, produkcji mydła, papieru i detergentów. Służy do udrażniania rur.
- Wodorotlenek potasu (KOH) (potaż żrący): Używany w produkcji mydła potasowego, elektrolitów i nawozów.
- Wodorotlenek wapnia (Ca(OH)2) (wapno gaszone): Używany w budownictwie (zaprawy murarskie), rolnictwie (do odkwaszania gleby) i przemyśle spożywczym.
- Wodorotlenek magnezu (Mg(OH)2): Składnik leków zobojętniających kwas żołądkowy (np. mleczko magnezjowe).
- Wodorotlenek glinu (Al(OH)3): Używany w produkcji kosmetyków, leków i jako koagulant w oczyszczalniach ścieków.
Tlenki a Wodorotlenki: Kluczowe Różnice
Najważniejsza różnica między tlenkami a wodorotlenkami polega na ich strukturze chemicznej. Tlenki zawierają tylko tlen połączony z innym pierwiastkiem, natomiast wodorotlenki zawierają grupę hydroksylową (-OH) połączoną z metalem. W konsekwencji, tlenki mogą mieć charakter kwasowy, zasadowy, amfoteryczny lub obojętny, podczas gdy wodorotlenki mają charakter zasadowy.
Inną różnicą jest sposób powstawania. Tlenki powstają najczęściej w wyniku spalania lub bezpośredniego łączenia pierwiastków z tlenem, natomiast wodorotlenki powstają w wyniku reakcji tlenków metali z wodą lub metali z wodą.
Bezpieczeństwo i Ostrożność
Zarówno tlenki, jak i wodorotlenki mogą być niebezpieczne. Niektóre tlenki (np. tlenek węgla(II)) są trujące, a niektóre (np. dwutlenek siarki) są szkodliwe dla środowiska. Wodorotlenki, szczególnie te rozpuszczalne w wodzie (zasady), są żrące i mogą powodować oparzenia. Dlatego podczas pracy z tymi związkami należy zachować szczególną ostrożność, używać odpowiednich środków ochrony (rękawice, okulary) i postępować zgodnie z instrukcjami.
Podsumowanie
Zrozumienie właściwości i zastosowań tlenków i wodorotlenków jest fundamentem chemii. Wiedza ta pozwala nam zrozumieć procesy zachodzące w naszym otoczeniu, od korozji metali po procesy biologiczne. Pamiętaj, że chemia to nauka eksperymentalna, więc warto samemu przeprowadzać proste doświadczenia, aby lepiej zrozumieć te zagadnienia. Bezpieczeństwo przede wszystkim!
Zatem, śmiało eksploruj świat chemii! Odkrywaj, pytaj i eksperymentuj. Zrozumienie tlenków i wodorotlenków to pierwszy krok do opanowania wiedzy chemicznej i zrozumienia świata, który nas otacza.