Tlenki I Wodorotlenki Klasa 7
Czy kiedykolwiek zastanawiałeś się, co tak naprawdę kryje się za nazwami "tlenek" i "wodorotlenek", których uczysz się na lekcjach chemii? Może wydaje Ci się to suchą teorią, ale uwierz mi, te substancje mają ogromny wpływ na otaczający nas świat. Od rdzy na rowerze, po mydło, którego używasz każdego dnia – tlenki i wodorotlenki są wszędzie! Spróbujmy wspólnie zgłębić tę wiedzę w zrozumiały i przystępny sposób, tak, aby chemia stała się ciekawsza niż dotychczas.
Czym są Tlenki?
Tlenki to związki chemiczne, w których tlen jest połączony z innym pierwiastkiem. Wyobraź sobie tlen jako element "łączący", który łączy się z różnymi innymi pierwiastkami, tworząc różnorodne substancje. Najprostszym przykładem jest rdza – tlenek żelaza, który powstaje, gdy żelazo łączy się z tlenem z powietrza w obecności wilgoci. To zjawisko, które z pewnością widziałeś wiele razy, prawda?
Podział Tlenków
Tlenki możemy podzielić ze względu na ich charakter chemiczny:
- Tlenki kwasowe (bezwodniki kwasowe): Reagują z wodą, tworząc kwasy. Przykład: Tlenek siarki(VI) (SO3), który w reakcji z wodą tworzy kwas siarkowy(VI). Są to tlenki niemetali.
- Tlenki zasadowe: Reagują z kwasami, tworząc sole. Przykład: Tlenek wapnia (CaO), używany do produkcji zaprawy murarskiej. Są to tlenki metali.
- Tlenki amfoteryczne: Reagują zarówno z kwasami, jak i z zasadami. Przykład: Tlenek glinu (Al2O3).
- Tlenki obojętne: Nie reagują ani z kwasami, ani z zasadami. Przykład: Tlenek węgla(II) (CO) – jest to gaz bardzo trujący!
Pamiętaj, że ten podział jest umowny i czasami tlenki mogą wykazywać cechy pośrednie.
Przykłady Tlenków i Ich Zastosowania
- Tlenek węgla(IV) (CO2): Uczestniczy w procesie fotosyntezy, jest wydychany przez ludzi i zwierzęta, stosowany w gaśnicach. Ciekawostka: Zbyt duża ilość CO2 w atmosferze przyczynia się do efektu cieplarnianego, co jest poważnym problemem ekologicznym.
- Tlenek krzemu(IV) (SiO2): Główny składnik piasku i kwarcu, wykorzystywany w produkcji szkła, ceramiki i materiałów budowlanych. Bez SiO2 nie byłoby naszych smartfonów ani szyb w oknach!
- Tlenek glinu (Al2O3): Składnik korundu i boksytu (rudy glinu), stosowany jako materiał ścierny i w produkcji aluminium. Al2O3 nadaje twardość szmerglowi, którego używamy do szlifowania.
- Tlenek żelaza(III) (Fe2O3): Składnik rdzy, stosowany jako pigment w farbach i w produkcji żelaza. Rdza to dowód na to, że tlenki są wszędzie wokół nas, nawet jeśli nie zdajemy sobie z tego sprawy.
Czym są Wodorotlenki?
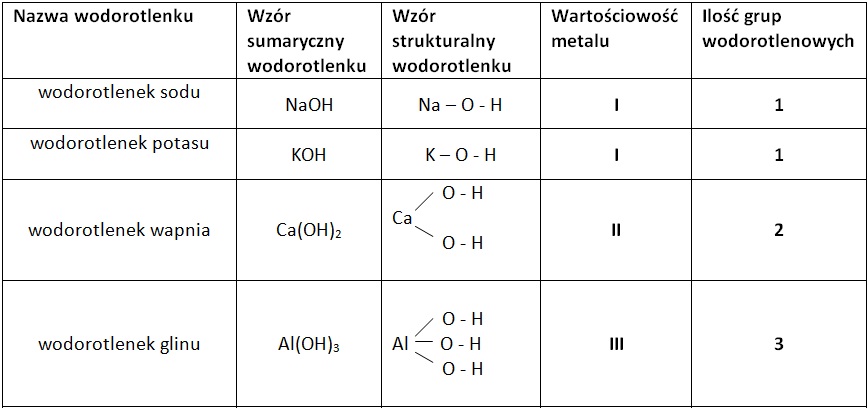
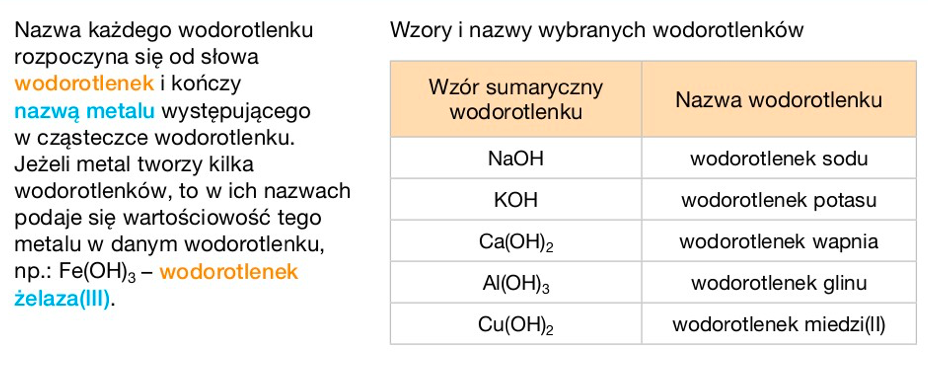
Wodorotlenki to związki chemiczne, które zawierają grupę wodorotlenową (OH-) połączoną z metalem. Działają jak "zasady", neutralizując kwasy. Najprostszym przykładem jest wodorotlenek sodu (NaOH) – składnik popularnych środków do udrażniania rur. Należy jednak pamiętać, że wodorotlenki są substancjami żrącymi i trzeba obchodzić się z nimi ostrożnie!
Charakterystyka Wodorotlenków
Wodorotlenki to związki jonowe, które w roztworach wodnych dysocjują na jony metalu (kationy) i jony wodorotlenkowe (OH-). To właśnie obecność jonów OH- sprawia, że roztwory wodorotlenków mają charakter zasadowy. Zazwyczaj, wodorotlenki metali z pierwszej i drugiej grupy układu okresowego pierwiastków (litowce i berylowce) są dobrze rozpuszczalne w wodzie. Roztwory takie nazywamy ługami. Należy pamiętać, że większość wodorotlenków metali przejściowych jest nierozpuszczalna w wodzie.
Przykłady Wodorotlenków i Ich Zastosowania
- Wodorotlenek sodu (NaOH): Składnik mydeł, środków do udrażniania rur, wykorzystywany w przemyśle chemicznym i papierniczym. Uważaj! NaOH jest silnie żrący i może powodować oparzenia!
- Wodorotlenek potasu (KOH): Stosowany w produkcji mydeł potasowych (bardziej miękkich niż mydła sodowe), elektrolitów w akumulatorach alkalicznych.
- Wodorotlenek wapnia (Ca(OH)2): Stosowany w budownictwie (wapno gaszone), do bielenia drzew, do regulacji pH gleby. Wapno gaszone to mieszanina Ca(OH)2 z wodą.
- Wodorotlenek magnezu (Mg(OH)2): Składnik leków zobojętniających kwas żołądkowy (np. mleczko magnezjowe), dodatek do past do zębów.
Tlenki i Wodorotlenki w Życiu Codziennym
Jak widzisz, tlenki i wodorotlenki otaczają nas z każdej strony. Czy wiesz, że pasta do zębów, której używasz rano, zawiera wodorotlenek magnezu? A rdza na łańcuchu Twojego roweru to nic innego jak tlenek żelaza. Nawet oddychanie wiąże się z przemianami tlenków (tlenek węgla(IV) jest produktem ubocznym). Te substancje są niezbędne w wielu procesach przemysłowych, w budownictwie, w rolnictwie, a nawet w medycynie!
Kontrargument: Niektórzy mogą uważać, że zapamiętywanie wzorów i nazw tlenków i wodorotlenków jest bezcelowe, bo przecież "nigdy się to nie przyda". Ale zrozumienie podstawowych zasad chemii pozwala lepiej zrozumieć świat wokół nas i podejmować bardziej świadome decyzje, na przykład dotyczące ochrony środowiska czy wyboru odpowiednich środków czystości.
Rozwiązywanie Problemów związanych z Tlenkami i Wodorotlenkami
Zamiast tylko uczyć się o problemach, spróbujmy zastanowić się nad rozwiązaniami:
- Zapobieganie korozji: Pokrywanie metali farbami, lakierami lub powłokami antykorozyjnymi (np. cynkowanie) zapobiega powstawaniu tlenków żelaza (rdzy).
- Neutralizacja kwasów: W przypadku wylania kwasu, można go zneutralizować za pomocą wodorotlenku (np. wodorotlenku wapnia – wapna gaszonego).
- Ograniczenie emisji CO2: Sadzenie drzew, ograniczenie zużycia paliw kopalnych, rozwój odnawialnych źródeł energii.
Pamiętaj, że nawet małe działania, jak segregacja śmieci czy oszczędzanie energii, mogą przyczynić się do poprawy stanu środowiska.
Podsumowanie
Tlenki i wodorotlenki to fascynujące związki chemiczne, które mają ogromny wpływ na nasze życie. Od rdzy na rowerze po środki czystości w domu – są one wszędzie! Mam nadzieję, że ten artykuł pomógł Ci zrozumieć, czym są te substancje i jak są wykorzystywane. Pamiętaj, że chemia to nie tylko suche fakty, ale także klucz do zrozumienia świata wokół nas. Wiedza to potęga!
Czy teraz, patrząc na otaczające Cię przedmioty, zastanowisz się, jakie tlenki i wodorotlenki kryją się w ich składzie?