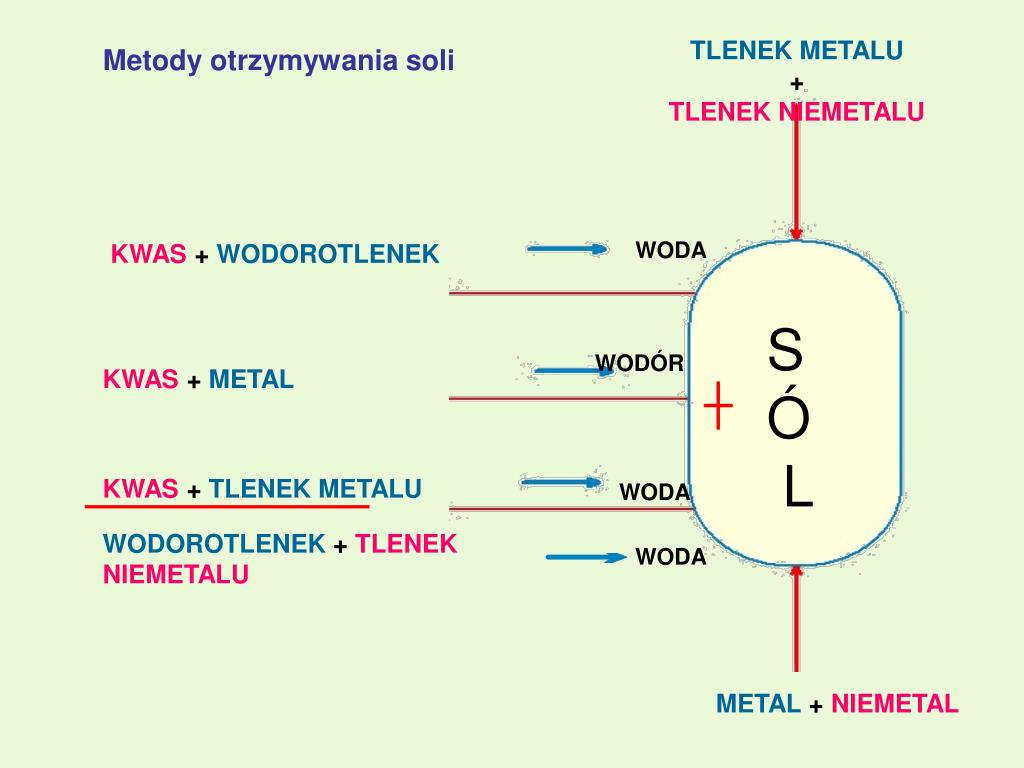
Tlenek Metalu Plus Tlenek Niemetalu
Hej! Zastanawiałeś się kiedyś, jak powstają niektóre związki chemiczne, które otaczają nas na co dzień? Dzisiaj zajmiemy się połączeniem dwóch specyficznych typów związków: tlenków metali i tlenków niemetali. Brzmi skomplikowanie? Spokojnie, rozłożymy to na czynniki pierwsze, tak żebyś zrozumiał wszystko krok po kroku.
Czym są tlenki?
Zacznijmy od podstaw. Tlenek to związek chemiczny, który składa się z dwóch elementów: tlenu i innego pierwiastka. Tlen w tlenku zawsze wykazuje stopień utlenienia -II. Proste, prawda? Przykłady tlenków znajdziesz wszędzie wokół siebie: woda (H2O), rdza (Fe2O3), czy dwutlenek węgla (CO2).
Tlenki metali
Tlenki metali, jak sama nazwa wskazuje, to związki tlenu z metalem. Metale to pierwiastki, które charakteryzują się dobrym przewodnictwem ciepła i elektryczności, są kowalne i ciągliwe. W układzie okresowym znajdziesz je po lewej stronie (z wyjątkiem wodoru). Przykłady metali to żelazo (Fe), miedź (Cu), glin (Al), wapń (Ca), magnez (Mg) i wiele innych.
Jak powstaje tlenek metalu? Najczęściej poprzez bezpośrednie łączenie metalu z tlenem. Wyobraź sobie rdzewiejące żelazo – to nic innego jak reakcja żelaza z tlenem z powietrza. Równanie reakcji wygląda następująco:
4Fe + 3O2 → 2Fe2O3
Gdzie Fe2O3 to właśnie tlenek żelaza(III), popularnie zwany rdzą. Inny przykład to spalanie magnezu. Pamiętasz błysk palącego się magnezu? To reakcja:
2Mg + O2 → 2MgO
Powstały MgO to tlenek magnezu, biały proszek.
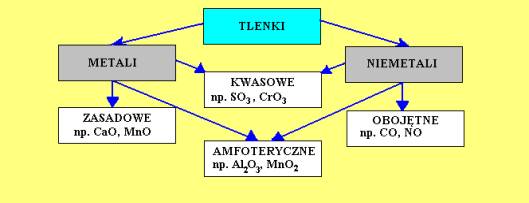
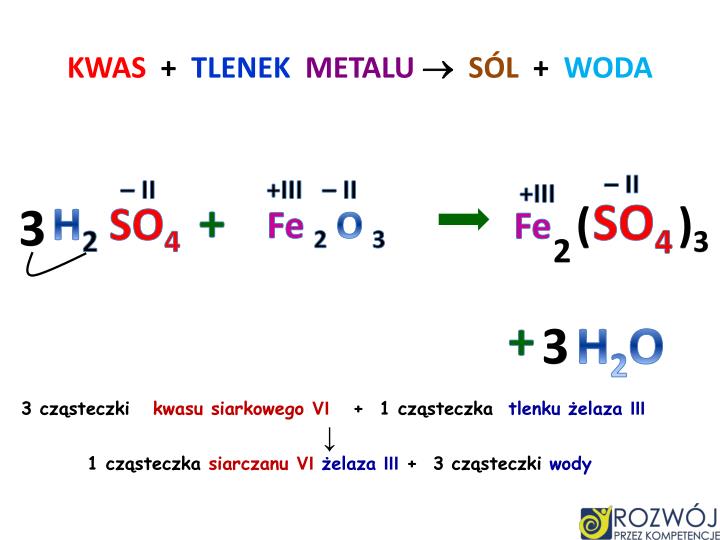
Tlenki metali często mają charakter zasadowy lub amfoteryczny. Oznacza to, że reagują z kwasami, a niektóre także z zasadami, tworząc sole i wodę. Na przykład, tlenek wapnia (CaO), zwany również wapnem palonym, reaguje z wodą, tworząc wodorotlenek wapnia (Ca(OH)2), który ma odczyn zasadowy.
Tlenki niemetali
Teraz przejdźmy do tlenków niemetali. Nietrnetale to pierwiastki, które generalnie nie przewodzą prądu (z wyjątkiem grafitu) i nie są kowalne. W układzie okresowym znajdziesz je po prawej stronie. Przykłady niemetali to tlen (O), siarka (S), węgiel (C), azot (N), chlor (Cl) i inne.
Tlenki niemetali również powstają poprzez łączenie niemetalu z tlenem. Najbardziej znanym przykładem jest spalanie węgla:
C + O2 → CO2
Powstały CO2 to dwutlenek węgla, gaz cieplarniany, który powstaje również podczas oddychania i spalania paliw.
Inny przykład to spalanie siarki:
S + O2 → SO2
Powstały SO2 to dwutlenek siarki, gaz o ostrym zapachu, który przyczynia się do powstawania kwaśnych deszczy.
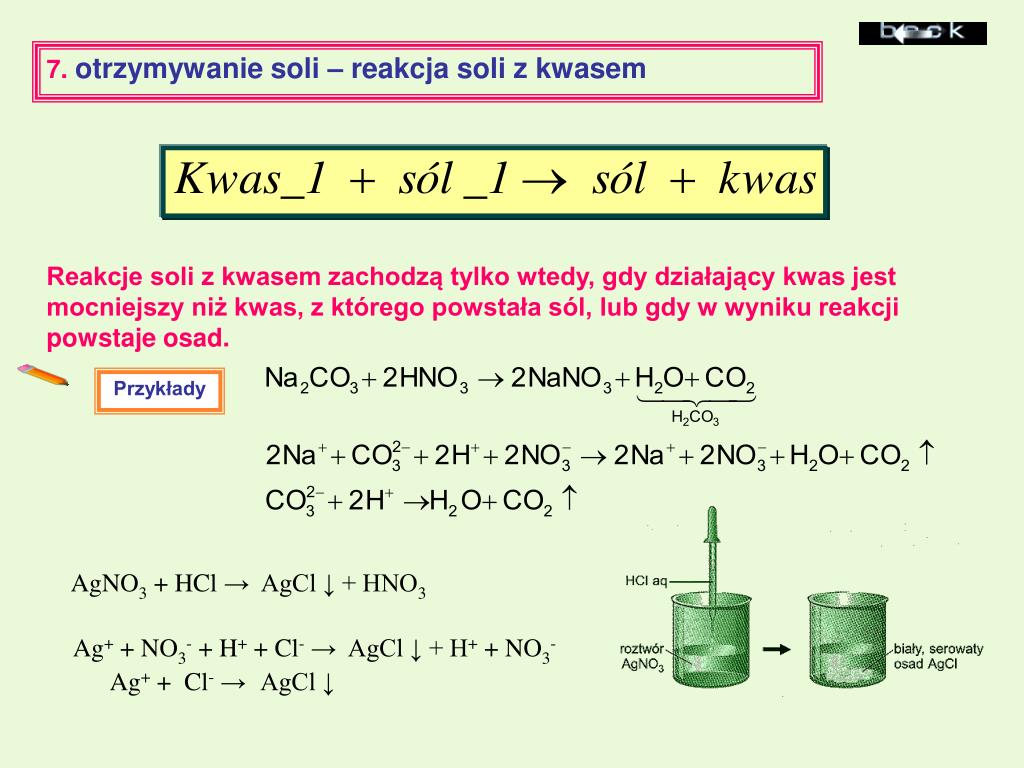
Tlenki niemetali zazwyczaj mają charakter kwasowy. Oznacza to, że reagują z wodą, tworząc kwasy, oraz z zasadami, tworząc sole i wodę. Na przykład, dwutlenek siarki reaguje z wodą, tworząc kwas siarkowy(IV) (H2SO3), a dwutlenek węgla reaguje z wodą, tworząc kwas węglowy (H2CO3). To właśnie obecność kwasu węglowego w wodzie gazowanej nadaje jej lekko kwaśny smak.
Reakcje tlenku metalu z tlenkiem niemetalu
Teraz dochodzimy do sedna: co się stanie, gdy połączymy tlenek metalu z tlenkiem niemetalu? Najczęściej, taka reakcja prowadzi do powstania soli. Dlaczego? Pamiętaj, że tlenki metali mają charakter zasadowy (lub amfoteryczny), a tlenki niemetali mają charakter kwasowy. Reakcja kwasu z zasadą prowadzi do neutralizacji i powstania soli.
Przykład:
CaO + CO2 → CaCO3
Tlenek wapnia (CaO, tlenek metalu) reaguje z dwutlenkiem węgla (CO2, tlenek niemetalu), tworząc węglan wapnia (CaCO3), który jest głównym składnikiem wapienia, marmuru i kredy. Ten proces zachodzi naturalnie w przyrodzie i ma duże znaczenie geologiczne.
Inny przykład:
Na2O + SO3 → Na2SO4
Tlenek sodu (Na2O, tlenek metalu) reaguje z trójtlenkiem siarki (SO3, tlenek niemetalu), tworząc siarczan(VI) sodu (Na2SO4), który jest wykorzystywany w przemyśle detergentów.
Dlaczego powstają sole?
Aby to lepiej zrozumieć, spójrzmy na to z punktu widzenia charakteru chemicznego. Tlenki metali, będąc zasadowe, "lubią" reagować z substancjami o charakterze kwasowym, czyli z tlenkami niemetali. Tlenki niemetali, będąc kwasowe, "lubią" reagować z substancjami o charakterze zasadowym, czyli z tlenkami metali. To jak magnesy o przeciwnych biegunach – przyciągają się.
Proces powstawania soli z tlenku metalu i tlenku niemetalu można traktować jako specyficzny rodzaj reakcji neutralizacji. Chociaż nie mamy tutaj klasycznego kwasu i zasady, to zachodzi podobny efekt – "kwasowy" tlenek niemetalu neutralizuje "zasadowy" tlenek metalu, a produktem jest sól.
Warto pamiętać, że nie wszystkie tlenki metali i niemetali reagują ze sobą łatwo. Reaktywność zależy od właściwości poszczególnych związków i warunków reakcji (temperatura, obecność katalizatora). Jednak generalnie, połączenie tlenku metalu z tlenkiem niemetalu prowadzi do powstania soli.
Podsumowanie
Podsumowując:
- Tlenki to związki tlenu z innym pierwiastkiem.
- Tlenki metali powstają z połączenia tlenu z metalem i mają charakter zasadowy lub amfoteryczny.
- Tlenki niemetali powstają z połączenia tlenu z niemetalem i mają charakter kwasowy.
- Reakcja tlenku metalu z tlenkiem niemetalu prowadzi do powstania soli.
Mam nadzieję, że teraz rozumiesz, jak zachodzi reakcja pomiędzy tlenkiem metalu i tlenkiem niemetalu. To kolejna cegiełka w Twojej wiedzy chemicznej! Pamiętaj, że chemia to nauka obserwacji i eksperymentów – im więcej będziesz obserwował i eksperymentował, tym lepiej zrozumiesz otaczający Cię świat.
Powodzenia w dalszej nauce!