Tlenek Metalu Kwas Sól Woda
Czy zastanawiałeś się kiedyś, jak powstają niektóre substancje chemiczne, które nas otaczają? Reakcje chemiczne, choć często niewidoczne gołym okiem, zachodzą nieustannie, tworząc nowe związki i przekształcając stare. Jedną z ważnych grup reakcji jest ta, w której uczestniczą tlenki metali, kwasy, sole i woda. Rozumienie tych interakcji jest kluczowe nie tylko w chemii, ale również w wielu dziedzinach życia, od przemysłu po ochronę środowiska.
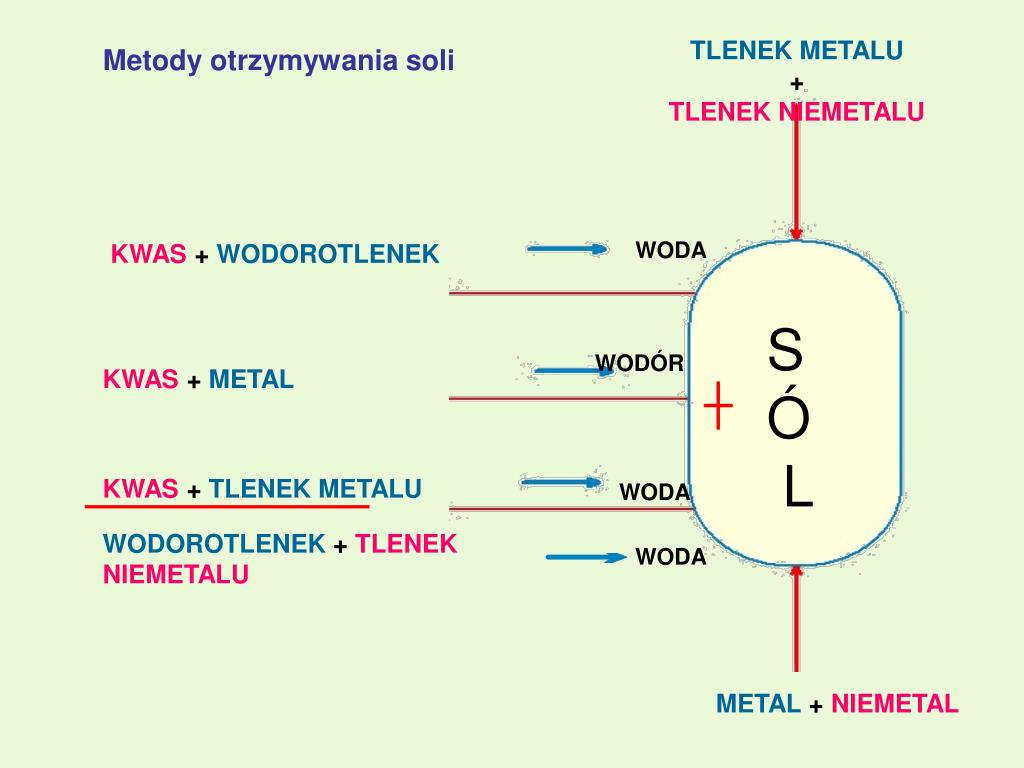
Tlenki Metali – Fundament Reakcji
Tlenki metali to związki chemiczne, które powstają w wyniku połączenia metalu z tlenem. Mają one różnorodne właściwości i zastosowania, a ich reaktywność zależy od rodzaju metalu i warunków reakcji. Zrozumienie, jak reagują z kwasami, solami i wodą, pozwala nam przewidzieć, jakie produkty powstaną i jak te reakcje możemy wykorzystać.
Reakcja Tlenków Metali z Kwasami
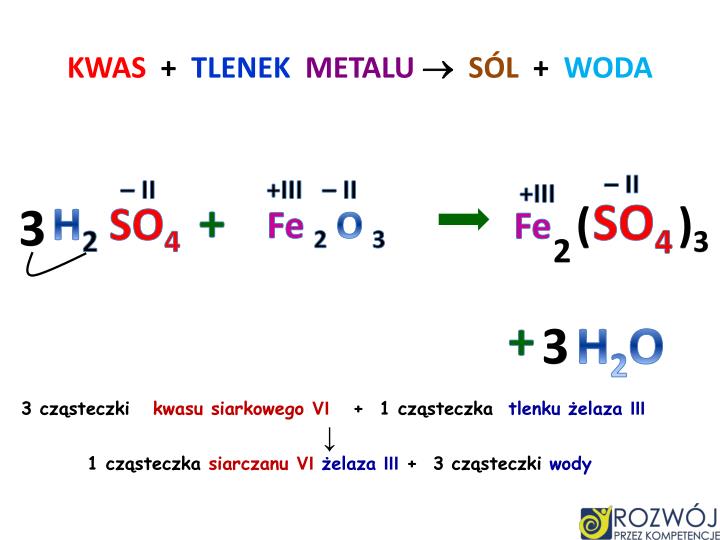
Jedną z najważniejszych reakcji, w których biorą udział tlenki metali, jest ich reakcja z kwasami. To reakcja neutralizacji, w której powstaje sól i woda. Jest to kluczowe dla zrozumienia, jak neutralizować kwasy i tworzyć nowe związki chemiczne. Na przykład:
CuO (tlenek miedzi(II)) + 2HCl (kwas chlorowodorowy) → CuCl2 (chlorek miedzi(II)) + H2O (woda)
W tej reakcji czarny tlenek miedzi(II) reaguje z bezbarwnym kwasem chlorowodorowym, tworząc niebiesko-zielony chlorek miedzi(II) i wodę. Jest to przykład, jak reakcje chemiczne mogą zmieniać barwy substancji i tworzyć nowe związki o odmiennych właściwościach.
Dlaczego to ważne? Reakcja tlenków metali z kwasami jest wykorzystywana w wielu procesach przemysłowych, np. w produkcji nawozów, leków i pigmentów. Dodatkowo, zrozumienie tej reakcji jest kluczowe w ochronie środowiska, na przykład w neutralizacji kwaśnych deszczy za pomocą wapna (tlenku wapnia).
Reakcja Tlenków Metali z Wodą
Nie wszystkie tlenki metali reagują z wodą, ale te, które to robią, tworzą zasady (wodorotlenki). Ta reakcja jest szczególnie charakterystyczna dla tlenków metali alkalicznych i ziem alkalicznych. Przykład:
Na2O (tlenek sodu) + H2O (woda) → 2NaOH (wodorotlenek sodu)
Tlenek sodu reaguje gwałtownie z wodą, tworząc silnie żrący wodorotlenek sodu, znany również jako soda kaustyczna. Podobnie reaguje tlenek potasu (K2O).
Warto wiedzieć: Reakcja tlenków metali z wodą jest wykorzystywana w przemyśle do produkcji zasad, które są niezbędne w wielu procesach chemicznych, takich jak produkcja mydła, papieru i aluminium.
Reakcja Tlenków Metali z Solami
Reakcje tlenków metali z solami są mniej powszechne niż reakcje z kwasami lub wodą, ale mogą zachodzić w specyficznych warunkach, zwłaszcza w wysokich temperaturach. Często są to reakcje wymiany, w których tlenek metalu reaguje z solą, tworząc nowy tlenek metalu i nową sól.
Przykład (w wysokiej temperaturze):
SiO2 (tlenek krzemu(IV)) + Na2CO3 (węglan sodu) → Na2SiO3 (krzemian sodu) + CO2 (dwutlenek węgla)
W tej reakcji tlenek krzemu(IV) (piasek) reaguje z węglanem sodu w wysokiej temperaturze, tworząc krzemian sodu (szkło wodne) i dwutlenek węgla. Jest to podstawowy proces w produkcji szkła.
Kwasy, Sole i Woda – Partnerzy w Reakcjach
Oprócz reakcji z tlenkami metali, kwasy, sole i woda również wchodzą w liczne interakcje między sobą. Zrozumienie tych interakcji pozwala nam przewidywać, jak będą zachowywać się różne substancje w roztworach i jakie reakcje mogą zajść.
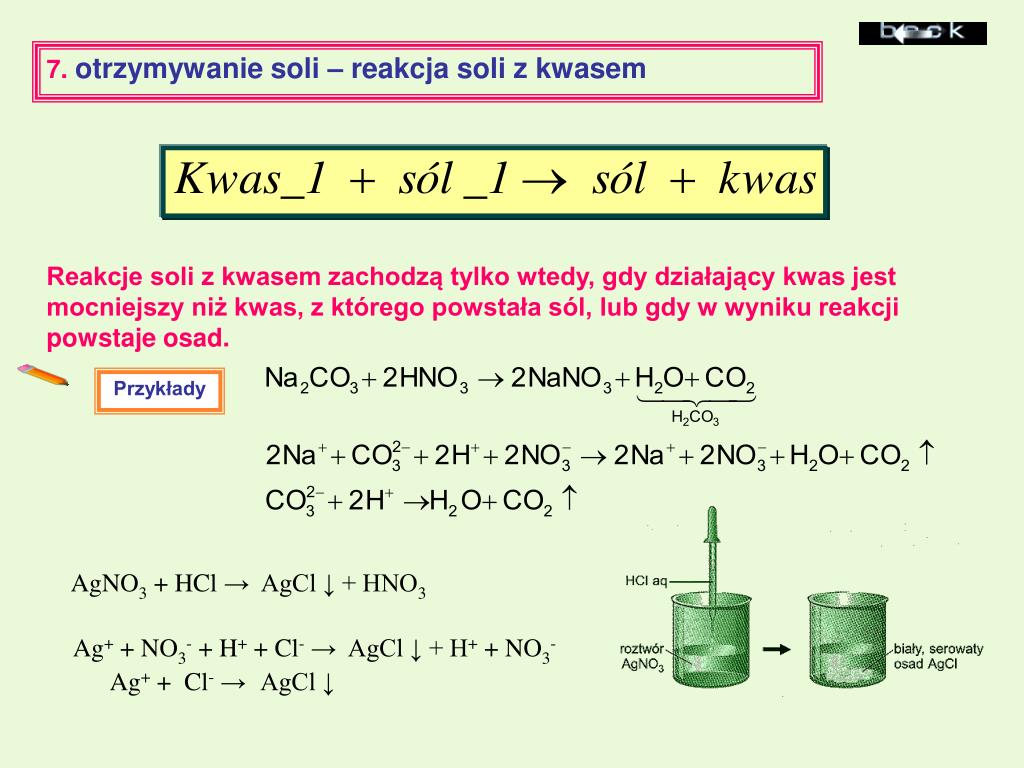
Reakcje Kwasów z Solami
Reakcje kwasów z solami mogą prowadzić do różnych produktów, w zależności od rodzaju kwasu i soli. Często dochodzi do wymiany jonów, tworząc nowy kwas i nową sól. Kluczowe jest tutaj uwzględnienie rozpuszczalności powstałych produktów.
Przykład:
2HCl (kwas chlorowodorowy) + CaCO3 (węglan wapnia) → CaCl2 (chlorek wapnia) + H2O (woda) + CO2 (dwutlenek węgla)
Kwas chlorowodorowy reaguje z węglanem wapnia (wapieniem) tworząc chlorek wapnia, wodę i dwutlenek węgla. Ta reakcja jest widoczna jako musowanie, ponieważ uwalnia się gazowy dwutlenek węgla.
Reakcje Soli z Solami
Reakcje soli z solami, zwłaszcza w roztworach wodnych, często prowadzą do wytrącania się osadów. Osad tworzy się, gdy jeden z produktów reakcji jest nierozpuszczalny w wodzie. Rozpuszczalność soli jest kluczowa dla przewidywania, czy reakcja zajdzie.
Przykład:
AgNO3 (azotan srebra) + NaCl (chlorek sodu) → AgCl (chlorek srebra) ↓ + NaNO3 (azotan sodu)
Azotan srebra reaguje z chlorkiem sodu, tworząc nierozpuszczalny chlorek srebra, który wytrąca się jako biały osad, oraz rozpuszczalny azotan sodu.
Reakcje Kwasów i Zasad (Neutralizacja)
Reakcja kwasu z zasadą to reakcja neutralizacji, w której powstaje sól i woda. Jest to jedna z najważniejszych reakcji w chemii. Stopień zneutralizowania roztworu można określić za pomocą wskaźników pH.
Przykład:
HCl (kwas chlorowodorowy) + NaOH (wodorotlenek sodu) → NaCl (chlorek sodu) + H2O (woda)
Kwas chlorowodorowy reaguje z wodorotlenkiem sodu, tworząc chlorek sodu (sól kuchenną) i wodę. Ta reakcja jest egzotermiczna, co oznacza, że wydziela się ciepło.
Praktyczne Zastosowania i Wskazówki
Zrozumienie reakcji między tlenkami metali, kwasami, solami i wodą ma ogromne znaczenie w wielu dziedzinach:
* Przemysł chemiczny: Produkcja nawozów, leków, tworzyw sztucznych, barwników i wielu innych produktów opiera się na tych reakcjach. * Ochrona środowiska: Neutralizacja kwaśnych deszczy, oczyszczanie ścieków, usuwanie metali ciężkich z gleby. * Medycyna: Neutralizacja kwasu żołądkowego, produkcja leków zobojętniających kwasy. * Gospodarstwo domowe: Usuwanie kamienia z czajnika (reakcja kwasu z tlenkiem metalu), czyszczenie powierzchni (reakcje soli).Wskazówki:
* Zawsze zachowuj ostrożność podczas pracy z kwasami i zasadami. Używaj odpowiednich środków ochrony osobistej (rękawice, okulary ochronne). * Zapoznaj się z kartami charakterystyki substancji przed rozpoczęciem eksperymentów. * Przeprowadzaj reakcje w dobrze wentylowanym pomieszczeniu, aby uniknąć wdychania szkodliwych oparów. * Pamiętaj o neutralizacji kwasów i zasad przed wylaniem ich do kanalizacji.Reakcje między tlenkami metali, kwasami, solami i wodą są fundamentalne dla chemii i mają szerokie zastosowanie w różnych dziedzinach. Zrozumienie tych reakcji pozwala nam nie tylko przewidywać, jak będą zachowywać się różne substancje, ale również wykorzystywać je do tworzenia nowych produktów i rozwiązywania problemów.