Test Z Chemii Klasa 8 Weglowodory

Cześć ósmoklasisto! Wiemy, że zbliża się ważny test z chemii, a temat węglowodorów może wydawać się trudny i abstrakcyjny. Nie martw się! Wiele osób ma podobne odczucia. Chcemy pomóc Ci zrozumieć ten temat w sposób prosty i przystępny. Postaramy się pokazać, że chemia to nie tylko wzory i definicje, ale także otaczający nas świat.
Czym są węglowodory i dlaczego są ważne?
Węglowodory to związki chemiczne zbudowane wyłącznie z dwóch pierwiastków: węgla (C) i wodoru (H). Brzmi prosto? No właśnie! To podstawa chemii organicznej i fundament wielu materiałów, z którymi stykamy się na co dzień.
Realny wpływ na Twoje życie
Pomyśl o paliwie, którym Twój tata tankuje samochód – benzyna, ropa naftowa, gaz ziemny – to wszystko mieszaniny węglowodorów. Plastikowe butelki, ubrania z poliestru, a nawet asfalt na drodze, po której jeździsz rowerem, to również produkty pochodne węglowodorów! Bez nich, nasze życie wyglądałoby zupełnie inaczej.
Węglowodory są również ważnym źródłem energii. Spalanie węglowodorów uwalnia energię, którą wykorzystujemy do ogrzewania domów, napędzania samochodów i produkcji energii elektrycznej. Niestety, spalanie to także wiąże się z problemami, o których porozmawiamy później.
Rodzaje węglowodorów - Krótkie wprowadzenie
Węglowodory dzielimy na różne grupy, w zależności od rodzaju wiązań między atomami węgla i kształtu cząsteczki.
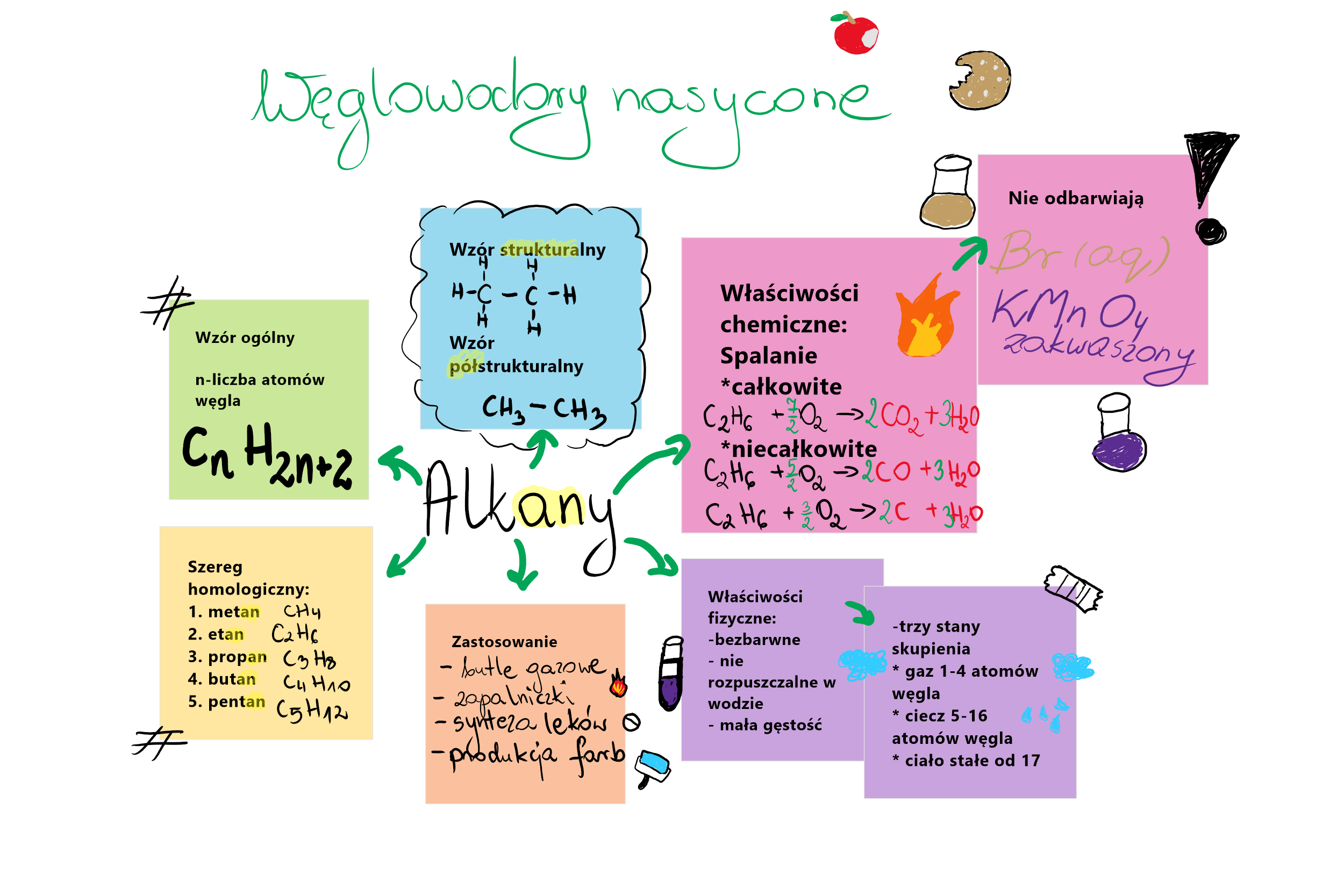
- Alkany (węglowodory nasycone): Zawierają tylko pojedyncze wiązania między atomami węgla. Przykład: metan (CH4), etan (C2H6). Można je porównać do klocków Lego połączonych tylko jednym rodzajem złącza - stabilne i przewidywalne.
- Alkeny (węglowodory nienasycone): Zawierają jedno podwójne wiązanie między atomami węgla. Przykład: eten (C2H4). Wyobraź sobie dwa klocki mocno połączone dwoma złączami - są bardziej reaktywne i gotowe do zmian.
- Alkiny (węglowodory nienasycone): Zawierają jedno potrójne wiązanie między atomami węgla. Przykład: etyn (C2H2). To tak jakby dwa klocki były połączone aż trzema złączami! Bardzo mocne połączenie, ale również bardzo chętne do reakcji.
- Węglowodory aromatyczne: Zawierają pierścień benzenowy. Charakteryzują się szczególnymi właściwościami chemicznymi. Przykład: benzen (C6H6).
Zapamiętanie tych nazw jest ważne, ale jeszcze ważniejsze jest zrozumienie, czym różnią się te rodzaje węglowodorów. To właśnie rodzaj wiązania wpływa na ich właściwości fizyczne i chemiczne.
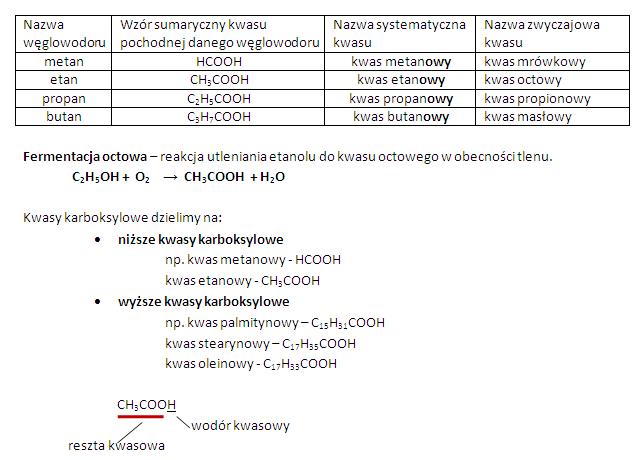
Wzory strukturalne i sumaryczne
Wzór sumaryczny pokazuje tylko liczbę atomów danego pierwiastka w cząsteczce, np. CH4 dla metanu. To tak jakbyś liczył ile masz klocków z danego koloru w zestawie. Wzór strukturalny pokazuje, jak te atomy są połączone ze sobą, czyli jak klocki są ułożone w budowli. Dzięki niemu widzimy wiązania między atomami i kształt cząsteczki. To bardzo ważne, bo kształt cząsteczki wpływa na jej właściwości.
Właściwości węglowodorów
Właściwości węglowodorów zależą od ich budowy, masy cząsteczkowej i rodzaju wiązań między atomami węgla.
- Stan skupienia: Krótkie węglowodory (np. metan, etan) są gazami. Dłuższe węglowodory (np. benzyna) są cieczami, a bardzo długie (np. parafina) są ciałami stałymi.
- Rozpuszczalność: Węglowodory są nierozpuszczalne w wodzie (są hydrofobowe). Wynika to z tego, że woda jest związkiem polarnym, a węglowodory – niepolarnym. Pamiętasz przysłowie "jak woda z olejem"? Olej to mieszanina węglowodorów!
- Palność: Węglowodory są palne. Podczas spalania węglowodorów powstaje dwutlenek węgla (CO2) i woda (H2O), a wydziela się energia. To właśnie tę energię wykorzystujemy jako paliwo.
Reakcje charakterystyczne dla węglowodorów
Węglowodory, zwłaszcza nienasycone, biorą udział w różnych reakcjach chemicznych.
- Spalanie: Reakcja z tlenem, w wyniku której powstaje dwutlenek węgla i woda (przy całkowitym spalaniu) lub tlenek węgla (II) i woda (przy niecałkowitym spalaniu). Pamiętaj o różnicy między spalaniem całkowitym i niecałkowitym!
- Addycja (przyłączanie): Reakcja charakterystyczna dla węglowodorów nienasyconych (alkenów i alkinów), polegająca na przyłączeniu atomów lub grup atomów do wiązania podwójnego lub potrójnego.
- Substytucja (podstawianie): Reakcja charakterystyczna dla węglowodorów nasyconych (alkanów), polegająca na podstawieniu atomu wodoru innym atomem lub grupą atomów.
Zrozumienie, dlaczego węglowodory nienasycone chętniej reagują niż nasycone, jest kluczowe. To wynika z obecności wiązań podwójnych i potrójnych, które są mniej trwałe niż wiązania pojedyncze.
Źródła i zastosowania węglowodorów
Głównym źródłem węglowodorów jest ropa naftowa i gaz ziemny. Powstają one z rozkładu szczątków roślin i zwierząt pod wpływem wysokiego ciśnienia i temperatury przez miliony lat. To tak jakby natura "gotowała" te szczątki przez bardzo długi czas, aż zamieniły się w ropę i gaz.
Węglowodory mają szerokie zastosowanie:
- Paliwa: Benzyna, ropa naftowa, gaz ziemny – do napędzania samochodów, samolotów, ogrzewania domów.
- Tworzywa sztuczne: Polietylen, polipropylen, polichlorek winylu (PVC) – do produkcji butelek, folii, rur, mebli.
- Rozpuszczalniki: Toluen, benzen – do rozpuszczania farb, lakierów, klejów.
- Surowce do syntezy organicznej: Do produkcji leków, barwników, kosmetyków.
Węglowodory a środowisko
Spalanie węglowodorów jest głównym źródłem emisji dwutlenku węgla (CO2), który jest gazem cieplarnianym przyczyniającym się do globalnego ocieplenia. Zbyt duża koncentracja CO2 w atmosferze powoduje zatrzymywanie ciepła słonecznego, co prowadzi do wzrostu temperatury na Ziemi i zmiany klimatu.
Dodatkowo, wycieki ropy naftowej stanowią poważne zagrożenie dla środowiska morskiego. Zanieczyszczają wodę, powodują śmierć zwierząt i roślin oraz zakłócają ekosystemy.
Kontrargument: Korzyści ekonomiczne
Oczywiście, eksploatacja i wykorzystanie węglowodorów przynoszą również korzyści ekonomiczne. Tworzą miejsca pracy, generują dochody dla państw i firm, a także umożliwiają rozwój technologiczny. Nie można ignorować tych aspektów. Ważne jest jednak, aby szukać równowagi między korzyściami ekonomicznymi a ochroną środowiska.
Co możemy zrobić?
Istnieje wiele sposobów na ograniczenie negatywnego wpływu węglowodorów na środowisko:
- Oszczędzanie energii: Wyłączanie światła, zakręcanie kranu, korzystanie z transportu publicznego lub roweru.
- Inwestowanie w odnawialne źródła energii: Energia słoneczna, wiatrowa, wodna.
- Recykling: Segregacja odpadów, dawanie drugiego życia przedmiotom.
- Rozwój technologii: Poszukiwanie bardziej efektywnych i czystszych sposobów spalania węglowodorów oraz opracowywanie alternatywnych paliw.
Podsumowanie i co dalej?
Węglowodory są wszechobecne w naszym życiu, ale ich wykorzystanie wiąże się z wyzwaniami. Zrozumienie ich budowy, właściwości i reakcji jest kluczowe do zdania testu, ale także do świadomego podejmowania decyzji w życiu codziennym.
Pamiętaj, że chemia to nie tylko nauka, ale także narzędzie do zrozumienia świata. Spróbuj dostrzegać chemię w otaczającej Cię rzeczywistości - w kuchni podczas gotowania, w ogrodzie podczas pielęgnacji roślin, a nawet podczas oddychania.
Przed Tobą test. Powtórz definicje, zapamiętaj najważniejsze wzory, ale przede wszystkim staraj się zrozumieć zasadę działania. Ucz się regularnie, a nie tylko na ostatnią chwilę. Zrób kilka testów próbnych, aby oswoić się z formą egzaminu. I pamiętaj: wiara w siebie to połowa sukcesu!
Kilka dodatkowych wskazówek przed testem:
- Upewnij się, że rozumiesz różnicę między wzorem sumarycznym a strukturalnym.
- Powtórz nazewnictwo podstawowych węglowodorów (metan, etan, propan, butan).
- Przeanalizuj reakcje spalania (całkowitego i niecałkowitego).
- Zwróć uwagę na wpływ węglowodorów na środowisko.
Trzymamy kciuki za Twój test!
Jakie działania, Twoim zdaniem, są najbardziej skuteczne w ograniczeniu negatywnego wpływu węglowodorów na środowisko i co Ty osobiście możesz zrobić w tej sprawie?