Test Z Chemii Klasa 8 Sole

Czy chemia w ósmej klasie spędza Ci sen z powiek? Szczególnie sole? Nie jesteś sam! Wiele uczniów ma problemy z tym tematem. Zrozumienie soli, ich właściwości, reakcji i zastosowań, może wydawać się trudne, ale z odpowiednim podejściem i odrobiną praktyki, z pewnością sobie poradzisz. Ten artykuł ma na celu pomóc Ci przygotować się do testu z chemii, skupiając się na solach. Zaczynamy!
Czym są sole? Podstawowe definicje i nazewnictwo
Zacznijmy od podstaw. Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Jest to reakcja zobojętniania. Generalnie, sole składają się z kationu metalu (lub kationu amonu, NH4+) i anionu reszty kwasowej. Zapamiętaj tę definicję! To klucz do zrozumienia dalszych zagadnień.
Przykłady soli:
- NaCl (chlorek sodu) - sól kuchenna
- CaCO3 (węglan wapnia) - składnik marmuru i kredy
- KNO3 (azotan potasu) - składnik nawozów
Nazewnictwo soli
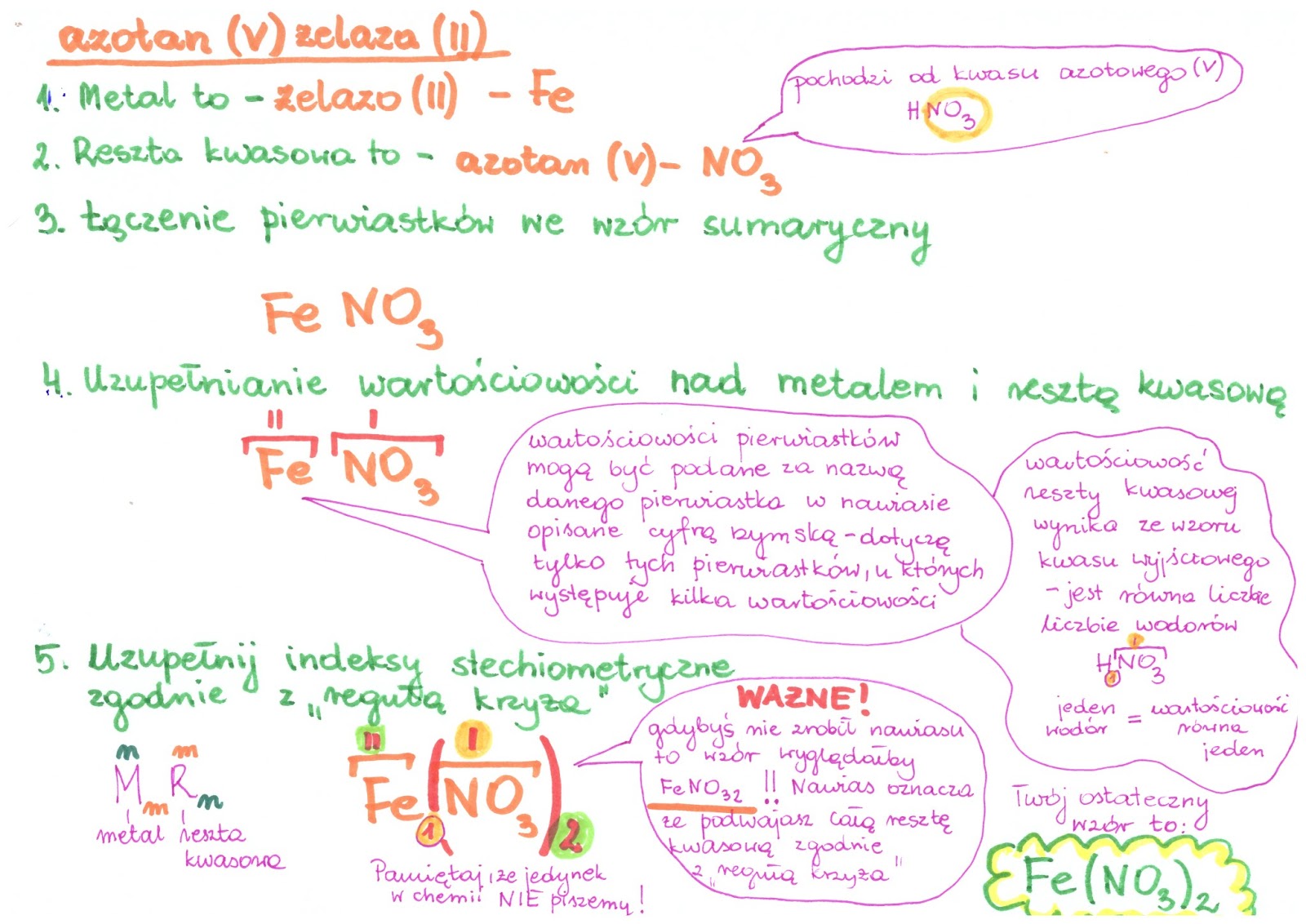
Nazwa soli składa się z dwóch członów: nazwy anionu reszty kwasowej i nazwy kationu metalu. Ważne jest, by znać nazwy reszt kwasowych pochodzących od różnych kwasów. Oto kilka przykładów:
- HCl (kwas solny) → Cl- (chlorek) → NaCl (chlorek sodu)
- H2SO4 (kwas siarkowy(VI)) → SO42- (siarczan(VI)) → CaSO4 (siarczan(VI) wapnia)
- H3PO4 (kwas fosforowy(V)) → PO43- (fosforan(V)) → Na3PO4 (fosforan(V) sodu)
- HNO3 (kwas azotowy(V)) → NO3- (azotan(V)) → KNO3 (azotan(V) potasu)
- H2CO3 (kwas węglowy) → CO32- (węglan) → MgCO3 (węglan magnezu)
Zwróć uwagę na wartościowość kationu metalu i anionu reszty kwasowej. Wzór sumaryczny soli musi być elektrycznie obojętny. Oznacza to, że suma ładunków dodatnich kationów musi być równa sumie ładunków ujemnych anionów.
Praktyczna wskazówka: Stwórz sobie tabelkę z najczęściej występującymi kwasami i odpowiadającymi im resztami kwasowymi. To bardzo ułatwi Ci nazewnictwo soli!
Metody otrzymywania soli
Istnieje wiele metod otrzymywania soli. Do najważniejszych należą:
- Reakcja kwasu z zasadą (zobojętnianie): HCl + NaOH → NaCl + H2O
- Reakcja metalu z kwasem: Zn + H2SO4 → ZnSO4 + H2↑ (pamiętaj, że nie wszystkie metale reagują z kwasami!)
- Reakcja tlenku metalu z kwasem: CuO + 2HCl → CuCl2 + H2O
- Reakcja tlenku niemetalu z zasadą: SO2 + 2NaOH → Na2SO3 + H2O
- Reakcja metalu z niemetalem (synteza): 2Na + Cl2 → 2NaCl
- Reakcja soli z kwasem: CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
- Reakcja soli z zasadą: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl (powstaje osad!)
- Reakcja soli z solą: AgNO3 + NaCl → AgCl↓ + NaNO3 (powstaje osad!)
Zwróć szczególną uwagę na reakcje, w których powstają osady. W chemii mówi się, że reakcja zachodzi, jeśli powstaje osad, gaz lub woda. Do zapamiętania: tablica rozpuszczalności jest Twoim przyjacielem! Użyj jej, aby przewidzieć, czy dana sól jest rozpuszczalna w wodzie, a więc czy powstanie osad.
Reakcje strąceniowe
Reakcje strąceniowe to reakcje, w których powstaje nierozpuszczalny osad. Żeby przewidzieć, czy dana reakcja zajdzie i powstanie osad, musisz znać rozpuszczalność soli w wodzie. Informacje na ten temat znajdziesz w tablicy rozpuszczalności. Pamiętaj, że osad oznaczamy strzałką w dół (↓).
Przykład: Mieszamy roztwory azotanu(V) srebra(I) (AgNO3) i chlorku sodu (NaCl). Z tablicy rozpuszczalności wiemy, że chlorek srebra(I) (AgCl) jest nierozpuszczalny w wodzie. Reakcja przebiega następująco:
AgNO3(aq) + NaCl(aq) → AgCl(s)↓ + NaNO3(aq)
Ważne! Symbol (aq) oznacza roztwór wodny, a (s) oznacza substancję stałą (osad).
Właściwości soli
Sole mają różne właściwości fizyczne i chemiczne. Do najważniejszych należą:
- Stan skupienia: Większość soli to substancje stałe w temperaturze pokojowej.
- Barwa: Sole mogą mieć różne barwy (np. chlorek miedzi(II) jest niebiesko-zielony, siarczan(VI) miedzi(II) jest niebieski).
- Rozpuszczalność w wodzie: Nie wszystkie sole rozpuszczają się w wodzie. Jak już wiesz, informacje na ten temat znajdziesz w tablicy rozpuszczalności.
- Przewodnictwo elektryczne: Stopione sole i roztwory wodne soli przewodzą prąd elektryczny, ponieważ zawierają jony.
- Temperatura topnienia i wrzenia: Sole mają zazwyczaj wysokie temperatury topnienia i wrzenia.
Zapamiętaj: Rozpuszczalność soli zależy od temperatury. Zazwyczaj rozpuszczalność wzrasta wraz ze wzrostem temperatury (choć są wyjątki!).
Zastosowania soli
Sole mają bardzo szerokie zastosowanie. Oto kilka przykładów:
- Chlorek sodu (NaCl): Sól kuchenna, konserwant, surowiec do produkcji chloru i wodorotlenku sodu.
- Węglan wapnia (CaCO3): Składnik cementu, kredy, marmuru, stosowany w budownictwie, przemyśle papierniczym i farmaceutycznym.
- Azotan potasu (KNO3): Składnik nawozów sztucznych, stosowany w rolnictwie.
- Siarczan(VI) magnezu (MgSO4): Sól Epsom, stosowana w medycynie jako środek przeczyszczający i w kosmetyce.
- Fosforan(V) wapnia (Ca3(PO4)2): Składnik nawozów sztucznych i kości.
Praktyczna wskazówka: Pomyśl o produktach, których używasz na co dzień. Czy wiesz, jakie sole są w nich zawarte? Sprawdź etykiety! To świetny sposób na utrwalenie wiedzy.
Przykładowe zadania i ćwiczenia
Najlepszym sposobem na przygotowanie się do testu jest rozwiązywanie zadań. Oto kilka przykładów:
- Napisz równania reakcji otrzymywania chlorku żelaza(II) różnymi metodami. (Podpowiedź: Użyj żelaza, kwasu solnego, tlenku żelaza(II), itd.)
- Zaproponuj metodę rozdzielenia mieszaniny chlorku sodu i piasku. (Podpowiedź: Wykorzystaj rozpuszczalność chlorku sodu w wodzie.)
- Jakie sole powstaną w wyniku reakcji:
- Kwas siarkowy(VI) + wodorotlenek potasu?
- Kwas azotowy(V) + tlenek miedzi(II)?
- Określ, czy zajdzie reakcja i napisz równanie jonowe skrócone:
- Chlorek baru + siarczan(VI) sodu
- Azotan(V) ołowiu(II) + chlorek potasu
- Oblicz masę cząsteczkową węglanu wapnia (CaCO3).
Pamiętaj: Regularne rozwiązywanie zadań to klucz do sukcesu! Nie bój się pytać nauczyciela o pomoc, jeśli masz problemy.
Podsumowanie i wskazówki na test
Przygotowując się do testu z soli, zwróć szczególną uwagę na:
- Definicję soli i ich skład.
- Nazewnictwo soli.
- Metody otrzymywania soli (równania reakcji!).
- Właściwości soli (rozpuszczalność, przewodnictwo elektryczne).
- Zastosowania soli.
- Tablicę rozpuszczalności.
- Reakcje strąceniowe.
- Obliczenia stechiometryczne (masa cząsteczkowa).
Na teście:
- Przeczytaj uważnie treść zadania.
- Zapisz wszystkie dane i szukane.
- Upewnij się, że równania reakcji są poprawne (zbilansowane!).
- Sprawdź jednostki.
- Nie zostawiaj pustych miejsc! Nawet jeśli nie wiesz, jak rozwiązać całe zadanie, spróbuj napisać cokolwiek związanego z tematem. Możesz dostać punkty za częściowe rozwiązanie.
Mam nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć sole i przygotować się do testu. Powodzenia!