Test Z Chemii Klasa 7 Dział 4

Witaj! Przygotowujesz się do sprawdzianu z chemii dla klasy 7, a konkretnie z działu 4? Ten artykuł pomoże Ci usystematyzować wiedzę i zrozumieć kluczowe zagadnienia. Omówimy najważniejsze punkty, wyjaśnimy je w przystępny sposób, a także podamy przykłady z życia codziennego, aby chemia stała się dla Ciebie bardziej zrozumiała i interesująca. Pamiętaj, grunt to solidne przygotowanie!
Kluczowe Zagadnienia Działu 4: Podstawy Reakcji Chemicznych
Dział 4 w podręcznikach do chemii dla klasy 7 zwykle koncentruje się na wprowadzeniu do reakcji chemicznych. Zaczynamy od podstawowych pojęć, takich jak substraty i produkty, a następnie przechodzimy do bardziej złożonych zagadnień, takich jak równania reakcji i zasada zachowania masy. Zrozumienie tych podstaw jest kluczowe do dalszej nauki chemii.
Substraty i Produkty: Kto Z Kim Reaguje i Co Powstaje?
Substraty to substancje początkowe, które biorą udział w reakcji chemicznej. To one ulegają przemianom i przekształcają się w inne substancje. Produkty to substancje, które powstają w wyniku reakcji chemicznej. Można to przedstawić w prosty sposób: Substraty → Produkty.
Przykład: Spalanie drewna. Substratem jest drewno (głównie celuloza), a produktami są dwutlenek węgla, woda, popiół i energia cieplna (światło i ciepło). Drewno, pod wpływem wysokiej temperatury i w obecności tlenu (który też jest substratem, choć często pomijany w uproszczonych opisach), ulega reakcji i tworzy nowe substancje.
Równania Reakcji: Język Chemii
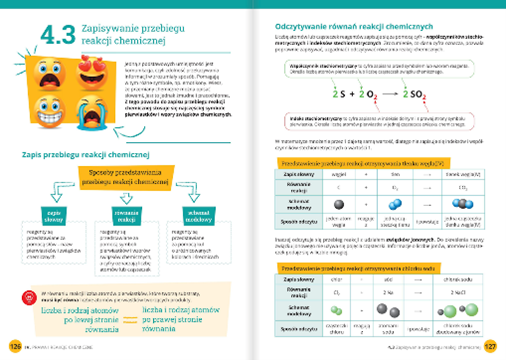
Równanie reakcji to zapis symboliczny reakcji chemicznej. Używa symboli chemicznych pierwiastków i wzorów chemicznych związków, aby przedstawić, jakie substancje reagują ze sobą i jakie substancje powstają. Ważne jest, aby równanie reakcji było zbilansowane, czyli aby liczba atomów każdego pierwiastka była taka sama po obu stronach równania. To wynika z zasady zachowania masy.
Przykład: Reakcja powstawania wody z wodoru i tlenu. Niezbilansowane równanie to: H2 + O2 → H2O. Zauważ, że po lewej stronie równania mamy dwa atomy tlenu (O2), a po prawej tylko jeden (w H2O). Zbilansowane równanie wygląda tak: 2H2 + O2 → 2H2O. Teraz po obu stronach równania mamy po cztery atomy wodoru i po dwa atomy tlenu.
Balansowanie równań reakcji wymaga praktyki. Zacznij od najtrudniejszych przypadków, czyli tych, w których masz związki o złożonych wzorach chemicznych. Pamiętaj, że zmieniasz współczynniki przed wzorami, a nigdy indeksy wewnątrz wzoru chemicznego. Zmiana indeksu zmienia substancję!
Zasada Zachowania Masy: Nic Nie Ginie, Nic Nie Powstaje, Tylko Się Przekształca
Zasada zachowania masy to jedno z fundamentalnych praw w chemii. Mówi ona, że podczas reakcji chemicznej masa substratów jest równa masie produktów. Oznacza to, że atomy nie giną i nie powstają nowe – po prostu zmieniają swoje połączenia. To właśnie dlatego tak ważne jest balansowanie równań reakcji.
Przykład: Jeśli spalisz 100 gram drewna, to masa wszystkich produktów spalania (dwutlenek węgla, woda, popiół) również wyniesie 100 gram (zakładając idealne warunki i uwzględniając masę tlenu zużytego w reakcji). Oczywiście, w praktyce trudno to dokładnie zmierzyć, bo część produktów (np. dwutlenek węgla) ulatnia się do atmosfery.
Wyobraź sobie budowlę z klocków LEGO. Reakcja chemiczna to jak przemeblowanie tej budowli. Możesz zmienić jej wygląd, ale liczba klocków (atomów) pozostaje taka sama. Nie możesz nagle dodać klocków znikąd ani ich usunąć.
Rodzaje Reakcji Chemicznych (Wprowadzenie)
W działu 4 często wprowadza się podstawowe rodzaje reakcji chemicznych. Chociaż bardziej szczegółowe omówienie nastąpi później, warto już teraz zapoznać się z podstawowymi kategoriami:
Reakcja Syntezy (Łączenia)
W reakcji syntezy dwa lub więcej substratów łączy się w jeden produkt. Ogólny schemat: A + B → AB.
Przykład: Reakcja łączenia żelaza z siarką w siarczek żelaza: Fe + S → FeS.
Reakcja Analizy (Rozkładu)
W reakcji analizy jeden substrat rozkłada się na dwa lub więcej produktów. Ogólny schemat: AB → A + B.
Przykład: Rozkład tlenku rtęci(II) na rtęć i tlen: 2HgO → 2Hg + O2.
Reakcja Wymiany
W reakcji wymiany następuje wymiana atomów lub grup atomów między substratami. Możemy wyróżnić reakcje pojedynczej i podwójnej wymiany.
Przykład (pojedyncza wymiana): Reakcja cynku z kwasem solnym: Zn + 2HCl → ZnCl2 + H2. Cynk "wypiera" wodór z kwasu solnego.
Przykład (podwójna wymiana): Reakcja chlorku srebra z bromkiem sodu: AgNO3 + NaCl → AgCl + NaNO3. Srebro "wymienia się" miejscami z sodem.
Czynniki Wpływające na Szybkość Reakcji
Szybkość reakcji to szybkość, z jaką substraty przekształcają się w produkty. Na szybkość reakcji wpływa kilka czynników:
Temperatura
Zazwyczaj wzrost temperatury przyspiesza reakcję. Wyższa temperatura oznacza, że cząsteczki mają więcej energii kinetycznej, co zwiększa prawdopodobieństwo skutecznych zderzeń między substratami.
Przykład: Gotowanie jajka. W wyższej temperaturze reakcje chemiczne zachodzą szybciej, co powoduje, że białko się ścina.
Stężenie Substratów
Zwiększenie stężenia substratów zazwyczaj przyspiesza reakcję. Większe stężenie oznacza więcej cząsteczek substratów w jednostce objętości, co zwiększa prawdopodobieństwo zderzeń między nimi.
Przykład: Spalanie drewna. Im więcej tlenu (większe stężenie tlenu), tym szybciej drewno się spala.
Stopień Rozdrobnienia Substratów (Powierzchnia Reakcji)
Zwiększenie stopnia rozdrobnienia substratów (zwiększenie powierzchni reakcji) przyspiesza reakcję. Drobniej zmielony proszek reaguje szybciej niż duży kawałek tej samej substancji, ponieważ większa powierzchnia jest dostępna dla reakcji.
Przykład: Mąka kukurydziana w zamkniętym pomieszczeniu może wybuchnąć. Bardzo drobny pył mąki ma ogromną powierzchnię i w kontakcie z iskrami szybko reaguje z tlenem, powodując gwałtowne spalanie.
Katalizatory
Katalizatory to substancje, które przyspieszają reakcję chemiczną, nie zużywając się w jej trakcie. Katalizator obniża energię aktywacji reakcji, czyli energię potrzebną do zapoczątkowania reakcji.
Przykład: Enzymy w naszym organizmie to biologiczne katalizatory, które przyspieszają wiele reakcji chemicznych niezbędnych do życia, np. trawienie pokarmu.
Przykłady Reakcji Chemicznych w Życiu Codziennym
Reakcje chemiczne zachodzą wszędzie wokół nas, a nawet wewnątrz nas! Oto kilka przykładów:
* Gotowanie: Pieczenie ciasta, smażenie jajek, gotowanie makaronu - wszystko to reakcje chemiczne, które zmieniają strukturę i składniki pokarmów. * Oddychanie: Proces, w którym wdychamy tlen, a wydychamy dwutlenek węgla. W naszych komórkach zachodzą reakcje utleniania glukozy, w wyniku których powstaje energia potrzebna do życia. * Rdzewienie żelaza: Reakcja żelaza z tlenem w obecności wody, prowadząca do powstania rdzy (tlenku żelaza). * Fotosynteza: Reakcja, w której rośliny wykorzystują energię słoneczną, aby przekształcić dwutlenek węgla i wodę w glukozę i tlen. * Trawienie: Rozkład złożonych związków organicznych (białek, węglowodanów, tłuszczów) na prostsze składniki, które mogą być wchłonięte przez organizm.Podsumowanie i Wskazówki
Dział 4 z chemii w klasie 7 wprowadza podstawy reakcji chemicznych. Kluczowe jest zrozumienie pojęć substratów i produktów, równań reakcji, zasady zachowania masy oraz podstawowych rodzajów reakcji. Pamiętaj o czynnikach wpływających na szybkość reakcji – temperaturze, stężeniu, stopniu rozdrobnienia i katalizatorach.
Wskazówki do nauki:
* Rozwiązuj zadania! Im więcej zadań rozwiążesz, tym lepiej zrozumiesz materiał. * Rysuj schematy reakcji. Wizualizacja pomaga w zapamiętywaniu. * Szukaj przykładów z życia codziennego. To ułatwia zrozumienie, że chemia to nie tylko abstrakcyjne wzory, ale coś, co nas otacza. * Nie bój się pytać! Jeśli czegoś nie rozumiesz, zapytaj nauczyciela, kolegów lub poszukaj informacji w internecie. * Powtarzaj regularnie! Regularne powtarzanie materiału utrwala wiedzę.Powodzenia na sprawdzianie! Pamiętaj, że z solidnym przygotowaniem dasz radę! Chemia może być fascynująca, wystarczy tylko ją zrozumieć.





![Test Z Chemii Klasa 7 Dział 4 SPRAWDZIAN Chemia. Klasa 7: Tlenki i wodorotlenki [5] - YouTube](https://i.ytimg.com/vi/lB-CSds7Eik/maxresdefault.jpg?sqp=-oaymwEmCIAKENAF8quKqQMa8AEB-AH-CYAC0AWKAgwIABABGGUgZShlMA8=&rs=AOn4CLBHWE0z9H8yRycaPTPRqUIQ2BXF2A)

