Tabela Wartościowości Chemia

Wartościowość to podstawowe pojęcie w chemii, które odnosi się do zdolności atomu danego pierwiastka do tworzenia wiązań chemicznych z innymi atomami. Rozumienie wartościowości jest kluczowe do poprawnego zapisu wzorów chemicznych związków, przewidywania ich właściwości i zrozumienia reakcji chemicznych.
Wprowadzenie do Wartościowości
Wartościowość, choć historycznie związana z liczbą atomów wodoru, z którymi dany atom może się połączyć, w nowoczesnym ujęciu definiowana jest jako liczba wiązań chemicznych, które atom może utworzyć. Należy jednak pamiętać, że wartościowość nie jest tożsama z liczbą elektronów walencyjnych (elektronów na ostatniej powłoce elektronowej), choć te dwa pojęcia są powiązane. Dla wielu pierwiastków wartościowość jest stała, natomiast dla innych może przyjmować różne wartości, zależnie od związku chemicznego.
Różnica pomiędzy Wartościowością a Stopniem Utlenienia
Często mylone pojęcia to wartościowość i stopień utlenienia. Wartościowość opisuje liczbę wiązań tworzonych przez atom, natomiast stopień utlenienia formalnie przypisuje ładunek atomowi w związku chemicznym, zakładając, że wszystkie wiązania są jonowe. Innymi słowy, stopień utlenienia uwzględnia elektroujemność atomów i przypisuje elektrony bardziej elektroujemnemu atomowi. Na przykład, w związku H2O tlen ma wartościowość II (tworzy dwa wiązania) i stopień utlenienia -II. Wartościowość jest zawsze liczbą dodatnią (lub zerem), podczas gdy stopień utlenienia może być dodatni, ujemny lub zerowy.
Kluczowe Punkty dotyczące Wartościowości
Stała i Zmienna Wartościowość
Niektóre pierwiastki wykazują stałą wartościowość, co oznacza, że tworzą zawsze taką samą liczbę wiązań. Do takich pierwiastków należą:
- Wodór (H): zawsze wartościowość I
- Tlen (O): zazwyczaj wartościowość II (z wyjątkiem nadtlenków, gdzie ma wartościowość I)
- Fluor (F): zawsze wartościowość I
- Metale alkaliczne (np. Li, Na, K): zawsze wartościowość I
- Metale ziem alkalicznych (np. Mg, Ca, Ba): zawsze wartościowość II
- Glin (Al): zawsze wartościowość III
Inne pierwiastki, zwłaszcza metale przejściowe, wykazują zmienną wartościowość, co oznacza, że mogą tworzyć różne liczby wiązań, w zależności od rodzaju związku chemicznego. Przykłady:
- Żelazo (Fe): wartościowość II (np. FeCl2) i III (np. FeCl3)
- Miedź (Cu): wartościowość I (np. CuCl) i II (np. CuCl2)
- Azot (N): wartościowość I, II, III, IV, V (w różnych związkach)
- Siarka (S): wartościowość II, IV, VI (w różnych związkach)
Dla pierwiastków o zmiennej wartościowości, nazwa związku chemicznego często zawiera informację o wartościowości danego pierwiastka, np. tlenek żelaza(II) (FeO) i tlenek żelaza(III) (Fe2O3).
Określanie Wartościowości na Podstawie Wzoru Związku
Jeśli znamy wzór chemiczny związku i wartościowość jednego z pierwiastków, możemy obliczyć wartościowość drugiego. Stosujemy zasadę, że suma wartościowości wszystkich atomów w cząsteczce musi być równa zero (dla cząsteczek obojętnych) lub równa ładunkowi jonu (dla jonów wieloatomowych).
Na przykład, w związku K2CrO4 (chromian potasu), potas (K) ma wartościowość I, a tlen (O) ma wartościowość II. Oznaczając wartościowość chromu (Cr) jako 'x', możemy ułożyć równanie:
2 * (wartościowość K) + 1 * (wartościowość Cr) + 4 * (wartościowość O) = 0
2 * (I) + 1 * (x) + 4 * (II) = 0
2 + x - 8 = 0
x = 6
Zatem chrom w chromianie potasu ma wartościowość VI.
Wartościowość a Wzory Strukturalne
Wzory strukturalne, przedstawiające sposób połączenia atomów w cząsteczce, odzwierciedlają wartościowość. Każda kreska we wzorze strukturalnym reprezentuje jedno wiązanie chemiczne. Atom tlenu, który ma wartościowość II, będzie zawsze tworzył dwa wiązania (np. dwa pojedyncze wiązania lub jedno wiązanie podwójne). Atom azotu, który ma wartościowość III, będzie tworzył trzy wiązania (np. trzy pojedyncze, jedno pojedyncze i jedno podwójne, lub jedno wiązanie potrójne).
Przykłady Zastosowania Wartościowości
Wzory Sumaryczne i Strukturalne
Rozumienie wartościowości jest niezbędne do poprawnego zapisu wzorów sumarycznych i strukturalnych związków chemicznych. Błędne przypisanie wartościowości prowadzi do błędnych wzorów, które nie odzwierciedlają rzeczywistej budowy cząsteczki.
Przykład: Chcemy zapisać wzór sumaryczny tlenku glinu. Glin (Al) ma wartościowość III, a tlen (O) ma wartościowość II. Szukamy najmniejszej wspólnej wielokrotności wartościowości, która wynosi 6. Dzielimy 6 przez wartościowość glinu (6/3 = 2) i wartościowość tlenu (6/2 = 3). Zatem wzór sumaryczny tlenku glinu to Al2O3.
Nazywanie Związków Chemicznych
Znajomość wartościowości jest niezbędna do poprawnego nazywania związków chemicznych, zwłaszcza tych, w których pierwiastki wykazują zmienną wartościowość. Jak wspomniano wcześniej, wartościowość danego pierwiastka oznaczamy w nazwie związku za pomocą cyfr rzymskich w nawiasie po nazwie pierwiastka.
Przykłady:
- FeO - Tlenek żelaza(II)
- Fe2O3 - Tlenek żelaza(III)
- CuCl - Chlorek miedzi(I)
- CuCl2 - Chlorek miedzi(II)
Bilansowanie Równań Reakcji Chemicznych
Wartościowość, a ściślej rzecz biorąc, stopnie utlenienia, odgrywają kluczową rolę w bilansowaniu równań reakcji redoks (reakcji utleniania-redukcji). Określenie zmian stopni utlenienia poszczególnych pierwiastków pozwala na prawidłowe dobranie współczynników stechiometrycznych w równaniu reakcji, tak aby zachowana była zasada zachowania masy i ładunku.
Zaawansowane Koncepcje Wartościowości
Hiperwartościowość
Pojęcie hiperwartościowości odnosi się do związków, w których atom centralny tworzy więcej wiązań, niż można by przewidzieć na podstawie prostej reguły oktetu. Przykłady to związki takie jak PF5 czy SF6. W takich związkach atom centralny "rozszerza" swój oktet, wykorzystując orbitale d.
Wartościowość ujemna
Chociaż tradycyjnie mówimy o wartościowości jako liczbie dodatniej, w niektórych kontekstach (np. opisując związki kompleksowe) można przypisać wartościowości ujemne niektórym ligandom, uwzględniając ich ładunek. Jest to jednak bardziej formalizm niż rzeczywiste odzwierciedlenie liczby wiązań.
Podsumowanie i Wezwanie do Działania
Zrozumienie wartościowości jest fundamentalne dla każdego, kto zajmuje się chemią. Od prostego zapisu wzorów chemicznych, przez nazywanie związków, aż po bilansowanie reakcji redoks – wartościowość stanowi podstawę. Pamiętaj o różnicy między wartościowością a stopniem utlenienia i ćwicz określanie wartościowości w różnych związkach. Im więcej ćwiczysz, tym lepiej zrozumiesz to kluczowe pojęcie.
Zachęcamy do:
- Rozwiązywania zadań z podręcznika chemii dotyczących określania wartościowości.
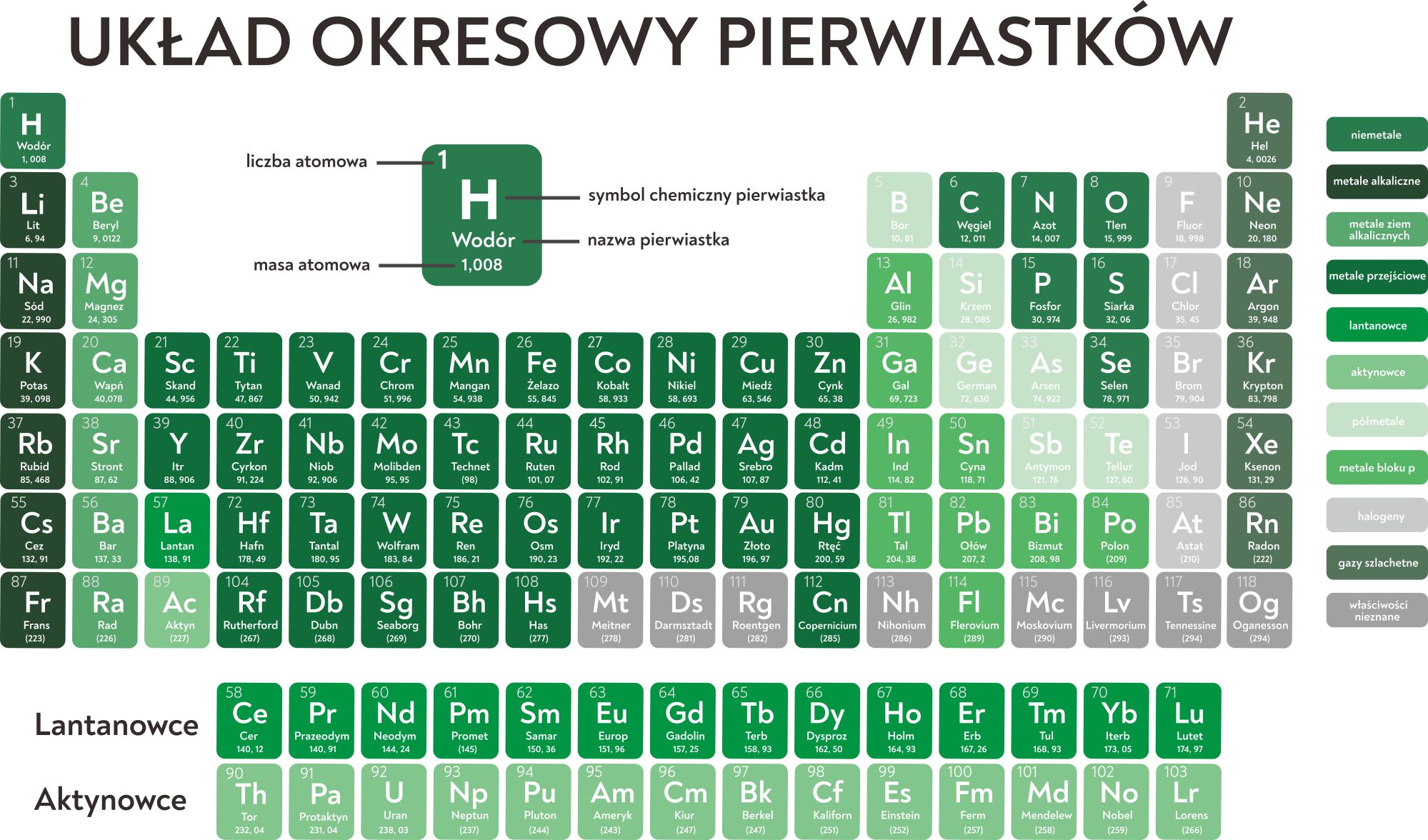
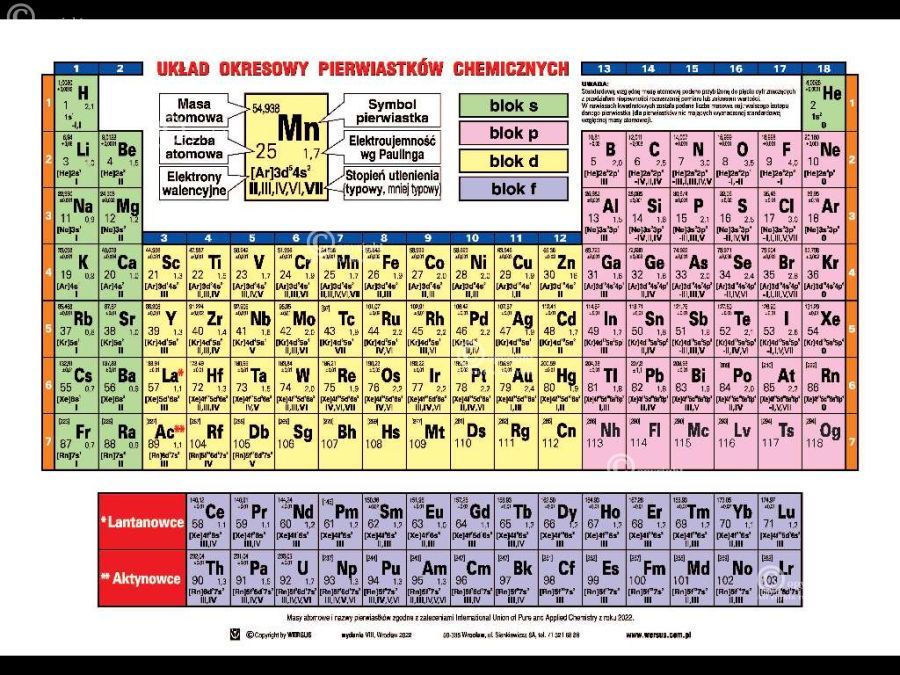
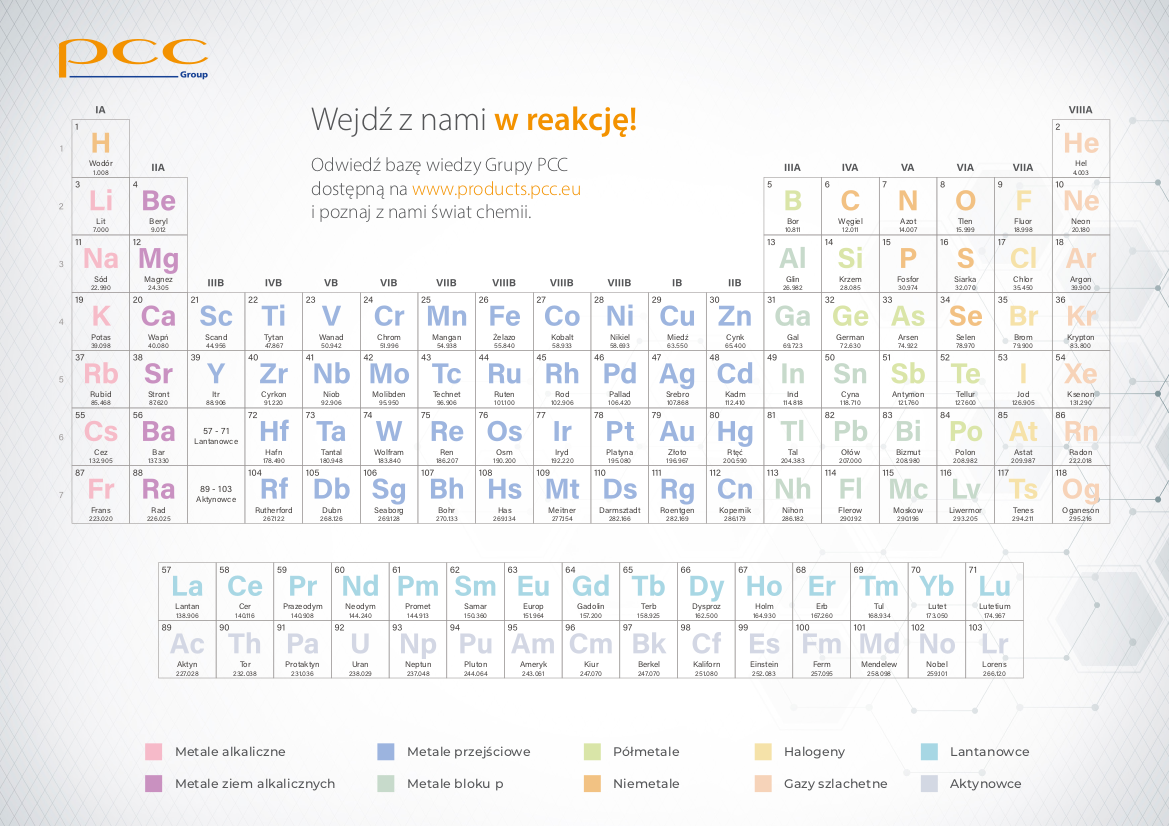
- Korzystania z tablicy Mendelejewa do sprawdzenia typowych wartościowości pierwiastków.
- Analizowania wzorów związków chemicznych i określania wartościowości poszczególnych atomów.
- Dyskutowania o wartościowości z kolegami i nauczycielami.
Pamiętaj, że opanowanie pojęcia wartościowości to inwestycja w Twoją przyszłość jako chemika! Powodzenia!