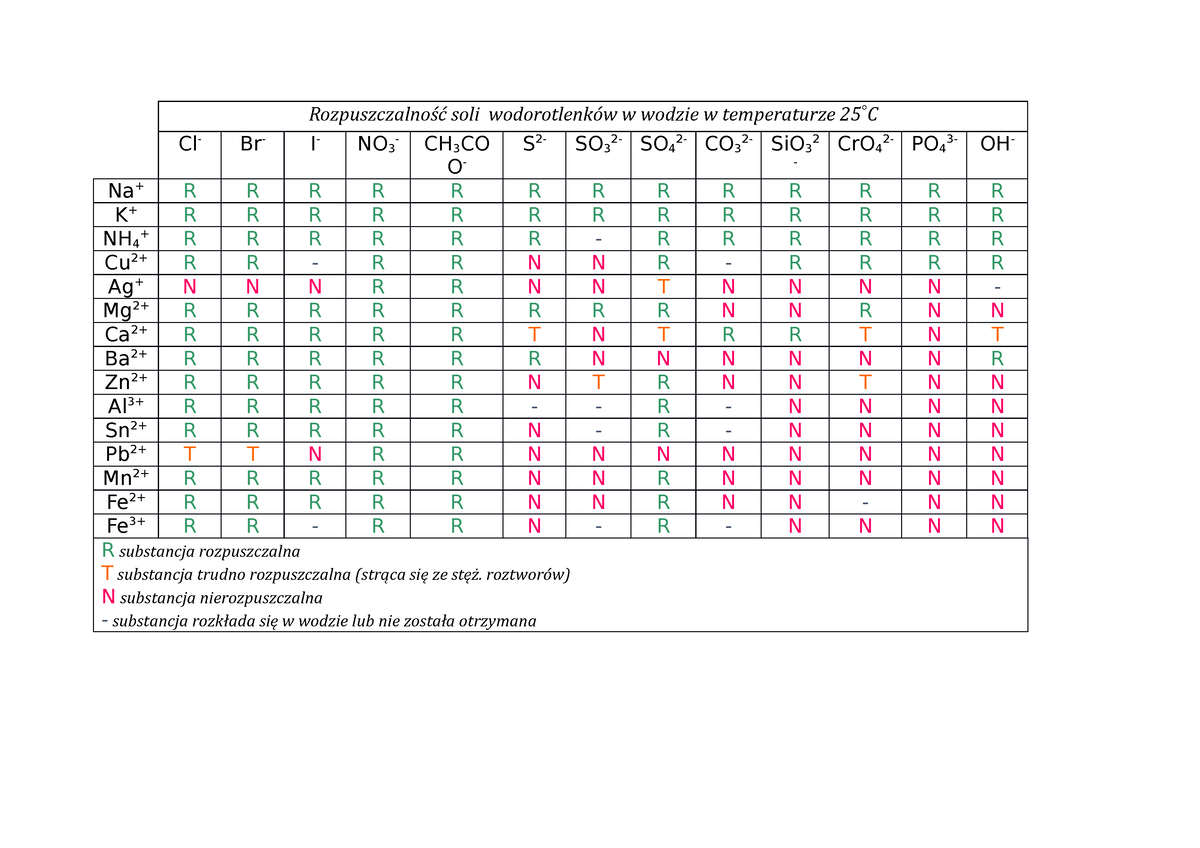
Tabela Rozpuszczalności Soli I Wodorotlenków W Wodzie

Rozpuszczalność substancji w wodzie to jedna z podstawowych właściwości fizykochemicznych, odgrywająca kluczową rolę w wielu procesach, zarówno w laboratoriach chemicznych, jak i w środowisku naturalnym. W przypadku soli i wodorotlenków, stopień ich rozpuszczalności w wodzie determinuje ich zachowanie w roztworach, wpływ na przewodnictwo elektryczne, reaktywność chemiczną, a nawet na biodostępność pierwiastków. Zrozumienie zasad rozpuszczalności i umiejętność przewidywania, które sole i wodorotlenki będą dobrze, a które słabo rozpuszczalne, jest niezbędne dla każdego, kto zajmuje się chemią, od uczniów szkół średnich po doświadczonych chemików.
Rozpatrywanie rozpuszczalności rozpoczyna się od obserwacji, że niektóre substancje łatwo dyspergują w wodzie, tworząc roztwory, podczas gdy inne pozostają nierozpuszczalne, osadzając się na dnie naczynia. Ta różnica w zachowaniu wynika z oddziaływań między jonami tworzącymi związek jonowy (czyli sól lub wodorotlenek) a cząsteczkami wody. Woda, będąc związkiem polarnym, wykazuje zdolność do solwatacji jonów, czyli otaczania ich cząsteczkami wody. Solwatacja kompensuje energię potrzebną do rozerwania wiązań jonowych w krysztale soli lub wodorotlenku. Jeśli energia solwatacji jest wystarczająco duża, aby zrekompensować energię sieci krystalicznej, to sól lub wodorotlenek ulega rozpuszczeniu. W przeciwnym przypadku, substancja pozostaje nierozpuszczalna.
Istnieje szereg ogólnych zasad, które pozwalają przewidywać rozpuszczalność soli i wodorotlenków. Zasady te nie są jednak absolutne i istnieją od nich wyjątki, ale stanowią one dobry punkt wyjścia do oceny rozpuszczalności danej substancji.
Zacznijmy od azotanów (NO3-). Wszystkie azotany są rozpuszczalne w wodzie. To bardzo ważna i użyteczna zasada, ponieważ azotany są powszechnie stosowane w nawozach i innych zastosowaniach, gdzie rozpuszczalność jest pożądana. Dalej chlorki (Cl-). Chlorki są generalnie rozpuszczalne, z kilkoma ważnymi wyjątkami. Chlorek srebra (AgCl), chlorek ołowiu(II) (PbCl2) i chlorek rtęci(I) (Hg2Cl2) są nierozpuszczalne. Należy pamiętać, że chlorek ołowiu(II) staje się nieco bardziej rozpuszczalny w gorącej wodzie.
Teraz siarczany (SO42-). Siarczany są również generalnie rozpuszczalne, ale i tutaj występują wyjątki. Siarczan baru (BaSO4), siarczan strontu (SrSO4) i siarczan ołowiu(II) (PbSO4) są nierozpuszczalne. Siarczan wapnia (CaSO4) jest słabo rozpuszczalny.
Przejdźmy do metali alkalicznych (grupa 1 układu okresowego: lit, sód, potas, rubid, cez, frans). Sole litu, sodu, potasu, rubidu, cezu i fransu są zazwyczaj rozpuszczalne. To kolejna bardzo ważna zasada, ponieważ metale alkaliczne odgrywają kluczową rolę w wielu procesach biologicznych i przemysłowych.
Wodorotlenki metali alkalicznych (LiOH, NaOH, KOH, RbOH, CsOH, FrOH) są rozpuszczalne. Wodorotlenki metali ziem alkalicznych (grupa 2 układu okresowego: beryl, magnez, wapń, stront, bar, rad) są mniej rozpuszczalne niż wodorotlenki metali alkalicznych. Wodorotlenek baru (Ba(OH)2) jest rozpuszczalny, wodorotlenek strontu (Sr(OH)2) jest słabo rozpuszczalny, a wodorotlenki magnezu (Mg(OH)2) i wapnia (Ca(OH)2) są praktycznie nierozpuszczalne. Wodorotlenek berylu (Be(OH)2) jest amfoteryczny, co oznacza, że może reagować zarówno z kwasami, jak i z zasadami.
Węglany (CO32-), fosforany (PO43-), siarczki (S2-) i krzemiany (SiO32-) są generalnie nierozpuszczalne, z wyjątkiem soli metali alkalicznych i amonu (NH4+). Oznacza to, że węglan sodu (Na2CO3), fosforan potasu (K3PO4), siarczek litu (Li2S) i krzemian potasu (K2SiO3) są rozpuszczalne, ale węglan wapnia (CaCO3), fosforan żelaza(III) (FePO4), siarczek miedzi(II) (CuS) i krzemian glinu (Al2SiO5) są nierozpuszczalne. Siarczki metali alkalicznych i amonu ulegają hydrolizie w wodzie, tworząc roztwory o odczynie zasadowym.
Sole amonowe (NH4+) są zazwyczaj rozpuszczalne.
Fluorki (F-) są generalnie nierozpuszczalne, z wyjątkiem fluorków metali alkalicznych (LiF, NaF, KF, RbF, CsF) i fluorku srebra (AgF). Fluorek wapnia (CaF2) jest słabo rozpuszczalny.
Czynniki Wpływające na Rozpuszczalność
Rozpuszczalność soli i wodorotlenków w wodzie nie jest wartością stałą i może być modyfikowana przez różne czynniki, takie jak temperatura, ciśnienie (dla gazów) i obecność innych substancji w roztworze (efekt wspólnego jonu).
-
Temperatura: Zazwyczaj, wraz ze wzrostem temperatury, rozpuszczalność większości soli i wodorotlenków wzrasta. Jest to związane z faktem, że proces rozpuszczania jest często procesem endotermicznym, czyli wymagającym dostarczenia energii. Dostarczenie energii w postaci ciepła sprzyja przemieszczaniu się równowagi w kierunku rozpuszczania. Są jednak wyjątki od tej reguły. Niektóre sole, takie jak siarczan ceru(III) (Ce2(SO4)3), wykazują zmniejszenie rozpuszczalności wraz ze wzrostem temperatury.
-
Ciśnienie: Ciśnienie ma znaczący wpływ na rozpuszczalność gazów w cieczach, ale w przypadku soli i wodorotlenków jego wpływ jest minimalny i zazwyczaj pomijalny, chyba że mówimy o bardzo wysokich ciśnieniach.
-
Efekt wspólnego jonu: Rozpuszczalność soli lub wodorotlenku zmniejsza się w roztworze zawierającym inny związek, który ma wspólny jon z rozpuszczaną solą. Na przykład, rozpuszczalność chlorku srebra (AgCl) w wodzie zmniejsza się w obecności chlorku sodu (NaCl), ponieważ oba związki zawierają jon chlorkowy (Cl-). Dodatek jonów chlorkowych przesuwa równowagę rozpuszczania chlorku srebra w lewo, powodując wytrącanie się osadu.
Pamiętaj, że zasady rozpuszczalności są przydatne, ale nie są one niezawodne. Warto się z nimi zapoznać, ale zawsze należy sprawdzać doświadczalnie, czy dana substancja jest rozpuszczalna w konkretnych warunkach. Szczegółowe dane dotyczące rozpuszczalności konkretnych związków można znaleźć w literaturze chemicznej, takiej jak podręczniki, tablice chemiczne i bazy danych. Rozpuszczalność jest wartością ilościową, wyrażaną zazwyczaj jako masa substancji rozpuszczonej w określonej objętości rozpuszczalnika (np. gramy na litr) lub jako stężenie molowe (mole na litr). Znajomość tych danych pozwala na precyzyjne planowanie eksperymentów chemicznych i analizę procesów zachodzących w roztworach.
Podsumowując, zrozumienie zasad rozpuszczalności soli i wodorotlenków jest kluczowe dla każdego, kto zajmuje się chemią. Znając te zasady i czynniki wpływające na rozpuszczalność, możemy przewidywać zachowanie substancji w roztworach, planować eksperymenty i interpretować wyniki analiz chemicznych. Chociaż istnieją ogólne reguły, zawsze warto pamiętać o wyjątkach i w razie wątpliwości odwołać się do literatury specjalistycznej. Rozpuszczalność, choć na pozór prosta, jest złożonym zjawiskiem, od którego zależy wiele procesów chemicznych i biologicznych.