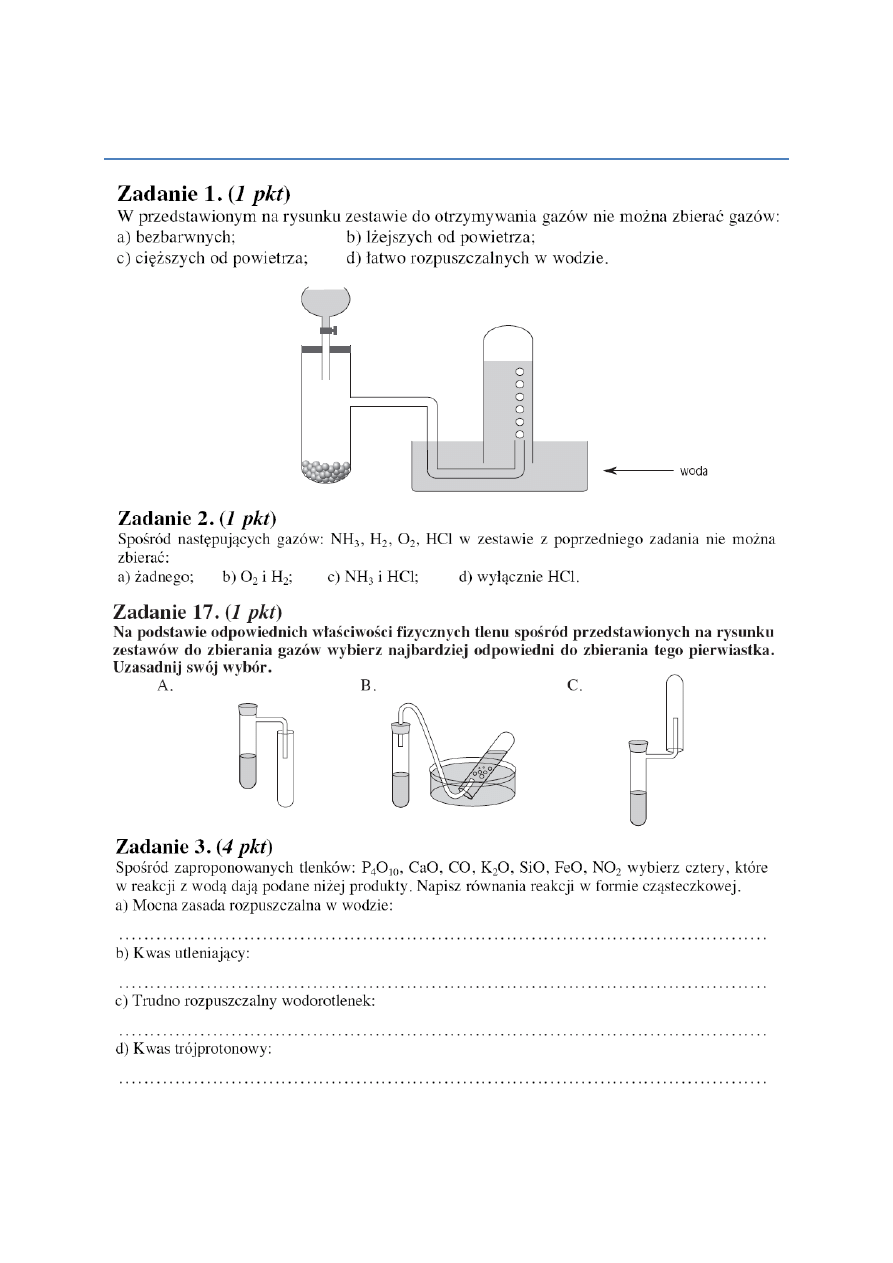
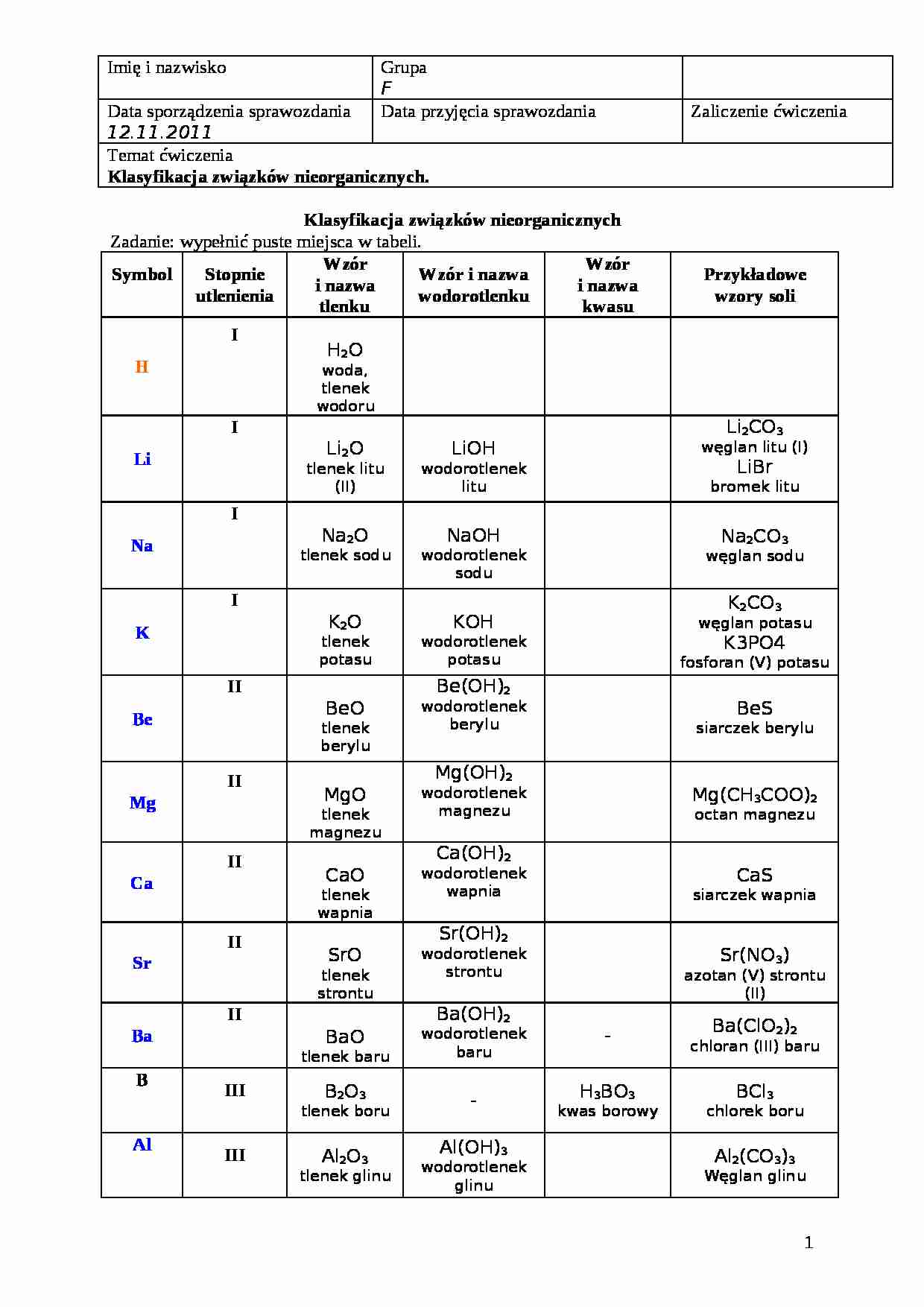
Systematyka Związków Nieorganicznych Sprawdzian Nowa Era

Sprawdzian z systematyki związków nieorganicznych od Nowej Ery – ojej, wiem, że to brzmi strasznie! Ale spokojnie, rozłóżmy to na czynniki pierwsze. Postaram się wytłumaczyć to tak, żebyś zrozumiał/a, nawet jeśli chemia nie jest Twoją ulubioną rzeczą na świecie. Skupimy się na tym, co najczęściej pojawia się na sprawdzianach, żebyś mógł/mogła zabłysnąć wiedzą.
Zacznijmy od podstawowych grup związków nieorganicznych. Mamy tlenki, wodorotlenki, kwasy i sole. Kluczem jest zrozumienie, co charakteryzuje każdą z tych grup i jak je rozpoznawać.
Tlenki: Królowie Połączeń z Tlenem
Tlenki to związki chemiczne, które powstają, gdy tlen łączy się z innym pierwiastkiem. Tlen jest tutaj bardzo ważny, bo to on decyduje, że mamy do czynienia z tlenkiem. Nazwa tlenku tworzona jest od słowa "tlenek" i nazwy pierwiastka, który połączył się z tlenem. Na przykład, jeśli tlen łączy się z magnezem, powstaje tlenek magnezu (MgO). Jeśli łączy się z węglem, powstaje tlenek węgla (np. CO lub CO2).
Bardzo ważne jest określanie wartościowości pierwiastków w tlenkach. Pamiętaj, że tlen zawsze ma wartościowość II (dwa), co oznacza, że "chce" związać się z dwoma atomami (albo jednym atomem dwuwartościowym). Aby napisać poprawny wzór tlenku, musisz "skrzyżować" wartościowości. Na przykład, jeśli masz tlenek glinu (Al) i wiesz, że glin ma wartościowość III, a tlen II, to "krzyżujesz" te wartościowości i otrzymujesz Al2O3. Dwójka od tlenu idzie do glinu, a trójka od glinu idzie do tlenu.
Pamiętaj o nazewnictwie. Jeśli pierwiastek tworzy kilka tlenków (czyli ma różne wartościowości), to musisz to zaznaczyć w nazwie. Na przykład, żelazo tworzy dwa tlenki: tlenek żelaza(II) (FeO) i tlenek żelaza(III) (Fe2O3). Cyfry rzymskie w nawiasie oznaczają wartościowość żelaza.
Wodorotlenki: Metal i Grupa OH
Wodorotlenki to związki, które zawierają metal i grupę wodorotlenową (OH). Grupa OH zawsze ma wartościowość I (jeden). Wodorotlenki powstają, gdy metal reaguje z wodą (nie wszystkie metale reagują z wodą!). Charakterystyczne dla wodorotlenków jest to, że mają odczyn zasadowy.
Nazwa wodorotlenku tworzona jest od słowa "wodorotlenek" i nazwy metalu. Na przykład, wodorotlenek sodu to NaOH, a wodorotlenek potasu to KOH. Podobnie jak w przypadku tlenków, jeśli metal ma różne wartościowości, to musisz to zaznaczyć w nazwie. Na przykład, wodorotlenek żelaza(II) to Fe(OH)2, a wodorotlenek żelaza(III) to Fe(OH)3.
Przy pisaniu wzorów wodorotlenków postępujesz podobnie jak w przypadku tlenków – "krzyżujesz" wartościowości. Pamiętaj tylko, że grupa OH traktowana jest jako całość, więc jeśli potrzebujesz więcej niż jednej grupy OH, musisz wziąć ją w nawias. Na przykład, jeśli masz wapń (Ca) o wartościowości II i grupę OH o wartościowości I, to otrzymujesz Ca(OH)2.
Kwasy: Wodór na Pierwszym Miejscu (zazwyczaj!)
Kwasy to związki, które zawierają wodór i resztę kwasową. Charakterystyczne dla kwasów jest to, że mają odczyn kwasowy (stąd nazwa!). Kwasy dzielimy na beztlenowe i tlenowe.
- Kwasy beztlenowe: To kwasy, które nie zawierają tlenu. Należą do nich np. kwas chlorowodorowy (HCl), kwas siarkowodorowy (H2S) i kwas fluorowodorowy (HF). Nazwa kwasu beztlenowego tworzona jest od słowa "kwas" i nazwy niemetalu z końcówką "-owodorowy". Czyli, jeśli masz chlor (Cl) i wodór (H), to powstaje kwas chlorowodorowy.
- Kwasy tlenowe: To kwasy, które zawierają tlen. Należą do nich np. kwas siarkowy(VI) (H2SO4), kwas azotowy(V) (HNO3) i kwas węglowy (H2CO3). Nazwa kwasu tlenowego tworzona jest od słowa "kwas" i nazwy niemetalu z odpowiednią końcówką, która zależy od wartościowości niemetalu. Końcówki to: -owy, -awy, -owy(V), -owy(VI), -owy(VII) – zależnie od wartościowości niemetalu w kwasie. Tutaj trzeba trochę zapamiętać, jaka końcówka pasuje do danej wartościowości.
Pisanie wzorów kwasów opiera się na ustaleniu wartościowości reszty kwasowej (czyli wszystkiego oprócz wodoru). Wartościowość reszty kwasowej jest równa liczbie atomów wodoru w kwasie. Na przykład, w kwasie siarkowym(VI) (H2SO4) są dwa atomy wodoru, więc reszta kwasowa SO4 ma wartościowość II.
Sole: Metal i Reszta Kwasowa
Sole to związki, które powstają w wyniku reakcji kwasu z zasadą (wodorotlenkiem) lub metalem. Składają się z metalu (lub grupy amonowej NH4+) i reszty kwasowej. Sole są solami życia, bo wiele z nich jest nam potrzebnych do funkcjonowania!
Nazwa soli tworzona jest od nazwy reszty kwasowej i nazwy metalu. Na przykład, chlorek sodu (NaCl) to sól kwasu chlorowodorowego (HCl) i sodu (Na). Siarczan(VI) potasu (K2SO4) to sól kwasu siarkowego(VI) (H2SO4) i potasu (K).
Pisanie wzorów soli opiera się na "krzyżowaniu" wartościowości metalu i reszty kwasowej. Pamiętaj, żeby ustalić wartościowość reszty kwasowej na podstawie liczby atomów wodoru w kwasie, z którego ta reszta pochodzi. Na przykład, jeśli masz siarczan(VI) żelaza(III), to wiesz, że reszta siarczanowa(VI) (SO4) pochodzi od kwasu siarkowego(VI) (H2SO4), który ma dwa atomy wodoru, więc reszta SO4 ma wartościowość II. Żelazo(III) ma wartościowość III. "Krzyżujesz" te wartościowości i otrzymujesz Fe2(SO4)3.
Jak Uczyć Się do Sprawdzianu?
Najlepszym sposobem na przygotowanie się do sprawdzianu z systematyki związków nieorganicznych jest ćwiczenie. Weź kartkę papieru i pisz wzory i nazwy różnych związków. Sprawdzaj swoje odpowiedzi w podręczniku lub internecie.
- Wzory i Nazwy: Napisz losowe wzory (np. K2O, H3PO4, Ca(OH)2) i spróbuj je nazwać. Potem weź losowe nazwy (np. tlenek glinu, kwas siarkowy(VI), wodorotlenek magnezu) i spróbuj napisać ich wzory.
- Reakcje: Przypomnij sobie, jak powstają tlenki, wodorotlenki, kwasy i sole. Spróbuj napisać równania reakcji chemicznych, które opisują te procesy.
- Wartościowość: Ćwicz ustalanie wartościowości pierwiastków w związkach chemicznych. To podstawa do pisania poprawnych wzorów.
- Zadania: Rozwiązuj zadania z podręcznika lub zbioru zadań. Im więcej zadań rozwiążesz, tym lepiej zrozumiesz materiał.
Pamiętaj, że kluczem do sukcesu jest regularna nauka i ćwiczenie. Nie zostawiaj wszystkiego na ostatnią chwilę! Jeśli masz jakieś pytania, nie bój się ich zadać nauczycielowi lub kolegom z klasy. Powodzenia na sprawdzianie! I pamiętaj, chemia wcale nie musi być taka straszna, jak się wydaje na pierwszy rzut oka! Trochę praktyki i wszystko stanie się jasne.