Substancje I Ich Przemiany Klasa 7

Czy kiedykolwiek zastanawiałeś się, co tak naprawdę dzieje się, gdy zapalasz zapałkę, gotujesz jajko, albo liście na drzewie zmieniają kolor jesienią? Odpowiedzi na te pytania kryją się w fascynującym świecie substancji i ich przemian. Ten artykuł, skierowany specjalnie do uczniów klasy 7, pomoże Ci zrozumieć podstawowe pojęcia związane z chemią i fizyką, a także pokaże, jak te procesy wpływają na nasze codzienne życie.
Czym są substancje?
Zacznijmy od początku. Czym właściwie jest substancja? Najprościej mówiąc, to materiał, z którego zbudowane są wszystkie przedmioty wokół nas. Może to być woda, powietrze, sól, cukier, metal, drewno – dosłownie wszystko!
Podział substancji
Substancje możemy podzielić na:
- Substancje proste (pierwiastki) – zbudowane z jednego rodzaju atomów, np. żelazo (Fe), tlen (O), siarka (S). Są to "cegiełki", z których budowane są wszystkie inne substancje.
- Substancje złożone (związki chemiczne) – zbudowane z dwóch lub więcej różnych rodzajów atomów połączonych ze sobą wiązaniami chemicznymi, np. woda (H2O), sól kuchenna (NaCl), cukier (C12H22O11).
Wyobraź sobie klocki Lego. Pojedyncze klocki to pierwiastki, a budowle, które z nich tworzysz, to związki chemiczne.
Mieszaniny
Oprócz czystych substancji, często spotykamy się z mieszaninami, czyli połączeniami różnych substancji, które nie reagują ze sobą chemicznie. Mieszaniny dzielimy na:
- Mieszaniny jednorodne (roztwory) – składniki są niewidoczne gołym okiem, np. powietrze, woda z solą, herbata. Wyglądają jednolicie.
- Mieszaniny niejednorodne – składniki są widoczne gołym okiem, np. piasek z wodą, zupa, sałatka. Możemy łatwo odróżnić poszczególne składniki.
Pomyśl o cukrze rozpuszczonym w herbacie – nie widzisz już oddzielnych kryształków cukru, prawda? To jest mieszanina jednorodna. Natomiast w zupie pomidorowej łatwo rozpoznasz kawałki makaronu, warzyw – to mieszanina niejednorodna.
Stany skupienia substancji
Substancje mogą występować w różnych stanach skupienia, w zależności od temperatury i ciśnienia. Najczęściej spotykamy się z trzema stanami:
- Stały – ma określony kształt i objętość, np. lód, kamień, drewno. Cząsteczki w ciele stałym są mocno związane i ułożone w regularny sposób.
- Ciekły – ma określoną objętość, ale przyjmuje kształt naczynia, np. woda, olej, sok. Cząsteczki w cieczy są mniej związane niż w ciele stałym i mogą się przemieszczać.
- Gazowy – nie ma określonego kształtu ani objętości, wypełnia całą dostępną przestrzeń, np. powietrze, para wodna, tlen. Cząsteczki w gazie poruszają się swobodnie i chaotycznie.
Woda jest świetnym przykładem substancji, która może występować we wszystkich trzech stanach skupienia: jako lód (stały), woda (ciekły) i para wodna (gazowy).
Przemiany stanów skupienia
Substancje mogą zmieniać swój stan skupienia pod wpływem zmiany temperatury. Oto najważniejsze przemiany:
- Topnienie – przejście ze stanu stałego w stan ciekły (np. lód topi się i zamienia w wodę).
- Krzepnięcie – przejście ze stanu ciekłego w stan stały (np. woda zamarza i zamienia się w lód).
- Parowanie – przejście ze stanu ciekłego w stan gazowy (np. woda paruje i zamienia się w parę wodną).
- Skraplanie – przejście ze stanu gazowego w stan ciekły (np. para wodna skrapla się i zamienia w wodę).
- Sublimacja – przejście ze stanu stałego bezpośrednio w stan gazowy (np. suchy lód "paruje" i zamienia się w gazowy dwutlenek węgla).
- Resublimacja – przejście ze stanu gazowego bezpośrednio w stan stały (np. szron powstaje, gdy para wodna zamarza bezpośrednio na powierzchni).
Pomyśl o lodówce. Dzięki procesowi krzepnięcia możemy przechowywać żywność dłużej. A gotowanie wody to nic innego jak parowanie!
Przemiany chemiczne i fizyczne
Przemiany, którym ulegają substancje, dzielimy na fizyczne i chemiczne.
Przemiany fizyczne
W przemianach fizycznych zmienia się tylko stan skupienia, wygląd lub kształt substancji, ale nie powstają nowe substancje. Przykłady:
- Krojenie papieru.
- Rozpuszczanie cukru w wodzie.
- Topnienie lodu.
- Gotowanie wody.
Możemy zmienić kształt papieru, ale nadal jest to papier. Możemy rozpuścić cukier w wodzie, ale nadal mamy wodę i cukier, tylko w innej formie.
Przemiany chemiczne
W przemianach chemicznych (reakcjach chemicznych) powstają nowe substancje o innych właściwościach. Przykłady:
- Spalanie drewna (powstaje popiół, dym i ciepło).
- Rdzewienie żelaza (powstaje rdza – tlenek żelaza).
- Gotowanie jajka (białko zmienia swoją strukturę).
- Fotosynteza (rośliny z dwutlenku węgla i wody tworzą glukozę i tlen).
Spalając drewno, nie mamy już drewna, tylko popiół i dym. Zardzewiałe żelazo to już nie to samo, co czyste żelazo. Gotowanie jajka powoduje nieodwracalne zmiany w jego strukturze.
Jak rozpoznać reakcję chemiczną?
Istnieje kilka wskazówek, które mogą pomóc nam stwierdzić, czy zaszła reakcja chemiczna:
- Zmiana koloru (np. brązowienie jabłka po przekrojeniu).
- Wydzielanie się gazu (np. bąbelki w napojach gazowanych, wydzielanie się dwutlenku węgla podczas pieczenia ciasta).
- Powstawanie osadu (np. zmętnienie roztworu po zmieszaniu dwóch cieczy).
- Wydzielanie się lub pochłanianie ciepła (np. spalanie węgla – wydzielanie ciepła, rozpuszczanie niektórych soli w wodzie – pochłanianie ciepła).
- Wydzielanie się światła (np. spalanie zapałki, świecenie świetlika).
Pamiętaj jednak, że nie zawsze wszystkie te objawy występują jednocześnie. Czasami wystarczy tylko jeden z nich, aby stwierdzić, że zaszła reakcja chemiczna.
Przykłady przemian substancji w życiu codziennym
Przemiany substancji zachodzą wszędzie wokół nas. Oto kilka przykładów:
- Gotowanie – wiele procesów gotowania to reakcje chemiczne, np. karmelizacja cukru, smażenie mięsa.
- Pieczenie – ciasto rośnie dzięki wydzielaniu się dwutlenku węgla podczas reakcji proszku do pieczenia z innymi składnikami.
- Oddychanie – w naszych komórkach zachodzi proces oddychania komórkowego, w którym glukoza reaguje z tlenem, dając energię, dwutlenek węgla i wodę.
- Rdzewienie – żelazo reaguje z tlenem i wilgocią, tworząc rdzę.
- Fotosynteza – rośliny wykorzystują energię słoneczną do przekształcania dwutlenku węgla i wody w glukozę i tlen.
- Przemysł – produkcja tworzyw sztucznych, leków, nawozów to procesy chemiczne na dużą skalę.
Zrozumienie tych procesów pozwala nam lepiej zrozumieć świat wokół nas i wykorzystywać je w różnych dziedzinach życia.
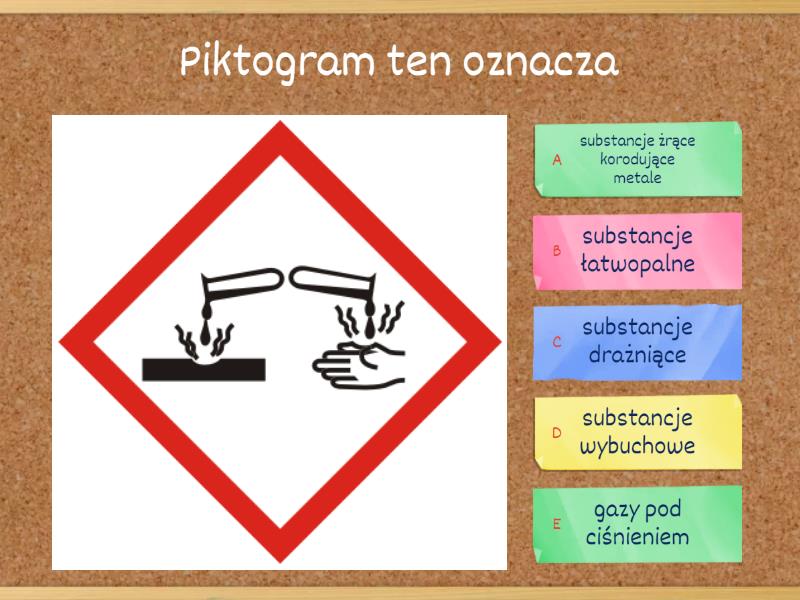
Bezpieczeństwo w laboratorium i w domu
Podczas eksperymentów chemicznych, zarówno w szkole, jak i w domu (pod opieką dorosłych!), bardzo ważne jest przestrzeganie zasad bezpieczeństwa. Pamiętaj, że niektóre substancje mogą być niebezpieczne!
- Zawsze czytaj etykiety na opakowaniach substancji chemicznych.
- Nie mieszaj nieznanych substancji ze sobą.
- Używaj odpowiednich ochron, np. okularów ochronnych, rękawic.
- Pracuj w dobrze wentylowanym pomieszczeniu.
- Zgłaszaj wszelkie wypadki nauczycielowi lub opiekunowi.
Przestrzeganie zasad bezpieczeństwa to podstawa udanych i bezpiecznych eksperymentów!
Podsumowanie
Poznaliśmy podstawowe pojęcia związane z substancjami i ich przemianami. Wiemy, co to są substancje proste i złożone, mieszaniny, stany skupienia, przemiany fizyczne i chemiczne. Zrozumieliśmy, jak te procesy zachodzą w naszym otoczeniu i jak ważne jest bezpieczeństwo podczas eksperymentów. Mam nadzieję, że ta wiedza pomoże Ci lepiej zrozumieć fascynujący świat chemii i fizyki, a także zachęci Cię do dalszych odkryć!
Pamiętaj, że nauka to ciągłe odkrywanie. Zadawaj pytania, eksperymentuj (pod opieką dorosłych!) i ciesz się zdobywaniem nowej wiedzy!