Stany Skupienia Fizyka Klasa 7

Witaj! Rozumiem, że zagadnienia dotyczące stanów skupienia w fizyce dla klasy 7 mogą wydawać się skomplikowane. Mnóstwo terminologii, przemiany... Może to sprawiać trudności, zwłaszcza gdy próbujesz zrozumieć, jak to wszystko działa w praktyce. Ale nie martw się! Postaramy się razem zgłębić ten temat, krok po kroku, tak, abyś mógł z łatwością zrozumieć i zapamiętać najważniejsze informacje.
Zapomnij na chwilę o podręczniku. Spróbujmy pomyśleć, jak stany skupienia wpływają na Twoje codzienne życie. Zastanów się, ile razy dziennie masz do czynienia z wodą – pijesz ją (ciecz), gotujesz herbatę (para wodna), a zimą jeździsz na łyżwach (lód). Wszystkie te rzeczy to woda, ale w różnych stanach skupienia! I to jest właśnie sedno sprawy – ten sam związek chemiczny (w tym przypadku woda, czyli H2O) może występować w różnych formach w zależności od warunków, w jakich się znajduje.
Stany Skupienia – Co to Właściwie Jest?
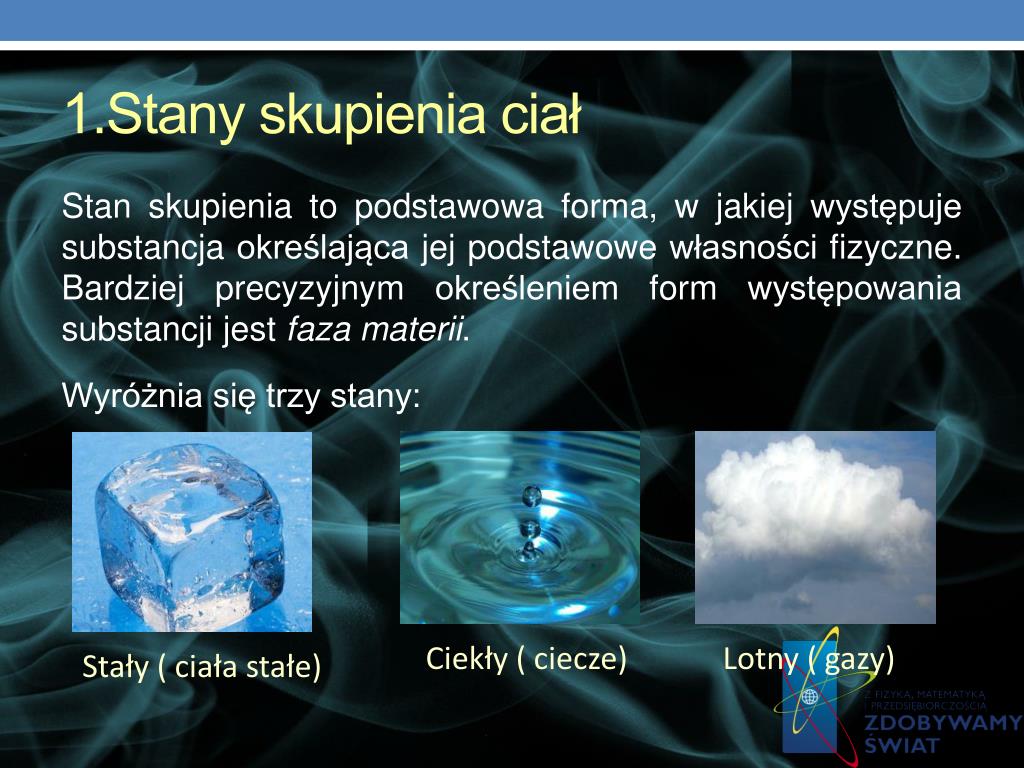
Mówiąc najprościej, stan skupienia to forma, w jakiej występuje dana substancja. Najczęściej spotykamy się z trzema podstawowymi stanami skupienia:
- Stały (ciało stałe): Ma określony kształt i objętość. Przykład: lód, kamień, drewno.
- Ciekły (ciecz): Ma określoną objętość, ale przyjmuje kształt naczynia, w którym się znajduje. Przykład: woda, olej, benzyna.
- Gazowy (gaz): Nie ma określonego kształtu ani objętości. Rozprzestrzenia się, zajmując całą dostępną przestrzeń. Przykład: para wodna, tlen, azot.
Oprócz tych trzech podstawowych stanów, istnieje również plazma, choć nie spotykamy się z nią tak często w codziennym życiu. Plazma to zjonizowany gaz, występujący na przykład w gwiazdach lub w piorunach. My jednak skupimy się na tych trzech najczęściej spotykanych.
Jak To Działa na Poziomie Molekularnym?
Aby zrozumieć, dlaczego substancje przybierają różne stany skupienia, musimy spojrzeć na to, jak zachowują się cząsteczki, z których te substancje są zbudowane.
- Ciało stałe: Cząsteczki są ułożone blisko siebie, w regularny sposób, i silnie się ze sobą oddziałują. Mają bardzo mało energii kinetycznej, dlatego drgają tylko w miejscu. Wyobraź sobie grupę uczniów siedzących w ławkach, równo i nieruchomo.
- Ciecz: Cząsteczki są ułożone blisko siebie, ale nie tak regularnie jak w ciele stałym. Oddziałują ze sobą słabiej i mają więcej energii kinetycznej, dzięki czemu mogą się przemieszczać. Wyobraź sobie tych samych uczniów po dzwonku na przerwę – nadal są blisko siebie, ale chodzą po klasie i rozmawiają.
- Gaz: Cząsteczki są od siebie bardzo oddalone i oddziałują ze sobą bardzo słabo. Mają dużo energii kinetycznej i poruszają się chaotycznie. Wyobraź sobie tych samych uczniów, którzy wyszli na boisko – rozbiegli się po całym terenie i każdy biega w inną stronę.
Przemiany Stanów Skupienia – Magiczne Zmiany
To, w jakim stanie skupienia znajduje się dana substancja, zależy od temperatury i ciśnienia. Zmiana temperatury lub ciśnienia może spowodować, że substancja zmieni swój stan skupienia. Te zmiany nazywamy przemianami stanów skupienia.
Oto najważniejsze przemiany:
- Topnienie: Przejście ze stanu stałego w stan ciekły. Przykład: lód topnieje i zamienia się w wodę.
- Krzepnięcie (zamarzanie): Przejście ze stanu ciekłego w stan stały. Przykład: woda zamarza i zamienia się w lód.
- Parowanie: Przejście ze stanu ciekłego w stan gazowy. Przykład: woda paruje i zamienia się w parę wodną.
- Skraplanie: Przejście ze stanu gazowego w stan ciekły. Przykład: para wodna skrapla się i zamienia się w wodę (np. rosa na trawie).
- Sublimacja: Przejście ze stanu stałego w stan gazowy, z pominięciem stanu ciekłego. Przykład: suchy lód (stały dwutlenek węgla) sublimuje i zamienia się bezpośrednio w gazowy dwutlenek węgla.
- Resublimacja: Przejście ze stanu gazowego w stan stały, z pominięciem stanu ciekłego. Przykład: szron osadzający się na szybach.
Zapamiętaj! Każda przemiana stanu skupienia związana jest z pobieraniem lub oddawaniem energii cieplnej. Na przykład, aby lód się stopił, musi pobrać energię z otoczenia (dlatego woda z topniejącego lodu jest zimna). Z kolei, aby woda zamarzła, musi oddać energię do otoczenia.
Temperatura Topnienia i Temperatura Wrzenia – Ważne Punkty odniesienia
Każda substancja ma charakterystyczną temperaturę topnienia i temperaturę wrzenia. Są to temperatury, w których zachodzą przemiany stanu skupienia w normalnych warunkach (czyli przy normalnym ciśnieniu atmosferycznym).
- Temperatura topnienia: Temperatura, w której substancja przechodzi ze stanu stałego w stan ciekły. Dla wody wynosi 0°C.
- Temperatura wrzenia: Temperatura, w której substancja przechodzi ze stanu ciekłego w stan gazowy. Dla wody wynosi 100°C.
Uwaga! Temperatury topnienia i wrzenia zależą od ciśnienia. Na przykład, w górach, gdzie ciśnienie jest niższe, woda wrze w temperaturze niższej niż 100°C.
Argumenty "Za" i "Przeciw" – Czy Wszystko Jest Takie Proste?
Można spotkać się z opiniami, że podział na stany skupienia jest zbyt uproszczony. To prawda, że istnieją substancje, które trudno jednoznacznie zakwalifikować do jednego stanu skupienia. Przykładem są ciekłe kryształy, które wykazują cechy zarówno cieczy, jak i ciał stałych. Stosuje się je np. w wyświetlaczach LCD.
Jednak uproszczony podział na stany skupienia jest bardzo przydatny do zrozumienia podstawowych właściwości materii i procesów zachodzących wokół nas. Pomaga nam przewidywać, jak zachowają się różne substancje w różnych warunkach i wykorzystywać te właściwości w praktyce.
Jak To Wykorzystać w Praktyce?
Zrozumienie stanów skupienia i przemian między nimi ma ogromne znaczenie w wielu dziedzinach życia. Oto kilka przykładów:
- Gotowanie: Wiedząc, jak temperatura wpływa na stan wody, możemy gotować potrawy.
- Przechowywanie żywności: Zamrażanie spowalnia procesy psucia się żywności.
- Medycyna: Azot w stanie ciekłym jest używany do zamrażania tkanek w celach leczniczych.
- Przemysł: Znajomość temperatur topnienia metali jest niezbędna do ich obróbki i formowania.
- Klimatologia: Zrozumienie cyklu hydrologicznego (parowanie, skraplanie, opady) jest kluczowe do przewidywania zmian klimatycznych.
Rozwiązania i Pomysły – Jak Ułatwić Naukę?
Jeśli masz trudności z zapamiętaniem wszystkich informacji o stanach skupienia, spróbuj:
- Tworzyć mapy myśli: Zapisz najważniejsze pojęcia i powiąż je ze sobą strzałkami.
- Rysować schematy: Narysuj schemat przedstawiający przemiany stanów skupienia.
- Szukać przykładów w życiu codziennym: Zastanów się, jak stany skupienia objawiają się w Twoim otoczeniu.
- Używać fiszek: Zapisz na jednej stronie pojęcie, a na drugiej jego definicję.
- Oglądać filmy edukacyjne: W Internecie znajdziesz mnóstwo filmów wyjaśniających zagadnienia związane ze stanami skupienia.
- Rozwiązywać zadania: Ćwiczenie czyni mistrza! Im więcej zadań rozwiążesz, tym lepiej zrozumiesz materiał.
- Nie bój się pytać: Jeśli czegoś nie rozumiesz, zapytaj nauczyciela, kolegę lub rodzica.
Pamiętaj: Nauka fizyki to proces. Nie zniechęcaj się, jeśli na początku coś wydaje się trudne. Z czasem, z pewnością wszystko stanie się jasne.
Na zakończenie…
Czy po przeczytaniu tego artykułu czujesz się pewniej w temacie stanów skupienia? Jakie przykłady stanów skupienia i ich przemian dostrzegasz w swoim najbliższym otoczeniu?

![Stany Skupienia Fizyka Klasa 7 [7] FIZ Trzy stany skupienia](https://thumbnails.genial.ly/5e7329791b366803f5e96412/pdf/1e5c257c-212f-461b-9b74-1a3500167f24.png)